
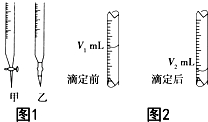
 现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:分析 (1)滴定管用蒸馏水洗涤后,还必须用待装液润洗,否则影响待装液的浓度;
(2)图1中甲为酸式滴定管,乙为碱式滴定管,氢氧化钠溶液为碱性溶液,应该用碱式滴定管盛放;
(3)根据图2中数据计算出消耗标准液体积,然后根据中和反应原理计算出待测液浓度.
解答 解:(1)碱式滴定管用蒸馏水洗净后,为了不影响氢氧化钠溶液的浓度,应该用标准NaOH溶液润洗2~3次,
故答案为:用标准NaOH溶液润洗2~3次;
(2)氢氧化钠溶液呈碱性,应该为碱式滴定管,图1中甲为玻璃活塞,为酸式滴定管,乙带有橡胶管和玻璃球特征,为碱式滴定管,所以应将标准NaOH溶液注入乙中,
故答案为:乙;
(3)根据图2可知,滴定过程中消耗待测液体积为:(V2-V1)mL,在待测液浓度为:c(HCl)=$\frac{n(NaOH)}{V[HCl(aq)]}$=$\frac{amol/L×({V}_{2}-{V}_{1})×1{0}^{-3}L}{V×1{0}^{-3}L}$=$\frac{{V}_{2}-{V}_{1}}{V}$mol/L,
故答案为:$\frac{{V}_{2}-{V}_{1}}{V}$.
点评 本题考查了中和滴定,题目难度不大,明确中和滴定操作方法为解答关键,注意掌握滴定管的构造、类型及使用方法,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:多选题
| A. | NH3在该反应中作还原剂,被氧化 | |
| B. | Si3N4具有硬度大、熔点高,说明Si3N4可用作耐高温材料 | |
| C. | 标准状况下,22.4LNH3所含原子总数目为4×6.02×1023 | |
| D. | 该反应每生成1mol Si3N4转移电子总数目为12×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2ml0.3mol/L的硅酸钠溶液中滴入稀盐酸所制得的硅酸胶体中胶粒的数目为0.0006NA | |
| B. | 常温下,1LpH=2的H2S溶液中H+的数目为0.01NA | |
| C. | 1mol铁粉与22.4L(标准状况)氯气充分反应,转移的电子数是3NA | |
| D. | 常温常压下,2.8gC4H8中有1.2NA的共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在分子组成上相差一个或若干个CH2原子团的物质一定互称为同系物 | |
| B. | 具有同分异构现象的有机化合物互称为同分异构体 | |
| C. | 同素异形体是指同种元素形成不同的单质 | |
| D. | 含有相同的质子数而不同的中子数的同一类元素的原子互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L 甲醇完全燃烧后生成的 CO2 分子个数约为$\frac{1}{2.42}$N A | |
| B. | N A个H2分子的质量约为2g,它所占的体积约为 22.4L | |
| C. | 标准状况下,22.4L CO2与CO的混合气体中含有的碳原子数为N A | |
| D. | 500mL 0.5mol/L 的Ca(ClO)2溶液中,含有ClO-的数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
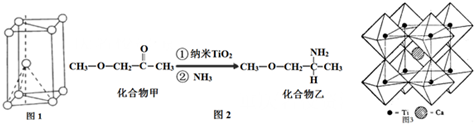
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
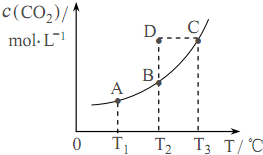 在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法正确的是( )
在密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g);CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法正确的是( )| A. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| B. | 在T2时,若反应处于状态D,则一定有V正<V逆 | |
| C. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H<0 | |
| D. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:选择题
下列分散系最不稳定的是
A.向NaOH溶液中通入CO2得到的无色溶液
B.向碘的水溶液中滴加四氯化碳充分振荡后,静置后的下层液体
C.向沸水中滴入饱和的FeCl3溶液得到的红褐色液体
D.向稀硫酸中加入BaCl2溶液得到的分散系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com