
N、O、Si、S是重要的非金属元素,下列说法正确的是
| A.N、O、S、Si的原子半径逐渐增大,非金属性逐渐减弱 |
| B.氮的氧化物和硫的氧化物既是形成光化学烟雾,又是形成酸雨的主要物质 |
| C.S、SO2和Si、SiO2四种物质均能与NaOH溶液反应,各自又能与某些酸反应 |
| D.N、Si、S的单质均能和氧气反应,生成的产物分别是NO2、SiO2和SO2 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
| A.洗气瓶中产生的沉淀是碳酸钡 |
| B.在Z导管出来的气体中无二氧化碳 |
| C.洗气瓶中产生的沉淀是亚硫酸钡 |
| D.在Z导管口有红棕色气体出现 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将导出H2S气体的导管点燃后伸入盛有一定量O2的集气瓶内,下列3个反应发生的先后顺序是
① 2H2S + O2 → 2S + 2H2O ② 2H2S + SO2 → 3S + 2H2O ③ 2H2S + 3O2 → 2SO2 + 2H2O
| A.①②③ | B.③①② | C.①③② | D.③②① |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于硅元素的说法,不正确的是
| A.光导纤维的主要成分是二氧化硅 | B.二氧化硅可以和水直接反应来制取硅酸 |
| C.硅可用作太阳能电池 | D.硅酸钠是制备硅胶和木材防火剂等的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列陈述正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
| D | Fe3+有强氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
近年来,酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(1)火力发电厂为除去有害气体SO2,并变废为宝,常采用尾气脱硫工艺,如图所示。写出尾气脱硫工艺中反应的化学方程式: 。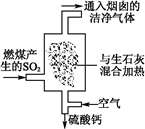
(2)宁波的火力发电厂通常建在海边,一般海水呈弱碱性,主要含有Na+、Mg2+、K+、Ca2+、Cl-、Br-、SO42-、HCO3-等离子。含有SO2的烟气也可以利用海水脱硫,其工艺流程如下图所示: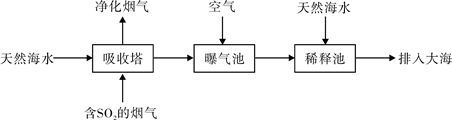
①向曝气池通入空气的目的是 。
②通入空气后的曝气池中的海水与天然海水相比,浓度有明显不同的离子是 。
| A.Cl- | B.Na+ | C.Mg2+ | D.HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
[探究一](1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)称取碳素钢6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用 (选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液
C.浓氨水 D.酸性KMnO4溶液
②乙同学取560 mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66 g。由此推知气体Y中SO2的体积分数为 。
[探究二]根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893 g·L-1。为此设计了下列探究实验装置(假设有关气体完全反应)。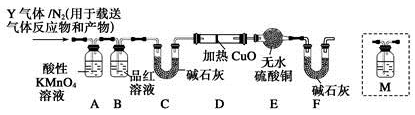
(3)装置B中试剂的作用是 。
(4)分析Y气体中的Q2气体是如何生成的 (用化学方程式表示)。
(5)已知洗气瓶M中盛装澄清石灰水,为确认Q2的存在,需在装置中添加洗气瓶M于 (填序号)。
A.A之前 B.A—B间
C.B—C间 D.C—D间
(6)如果气体Y中含有Q1,预计实验现象应是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4(1) △H1= -195kJ·mol-1
②N2H4(1) + O2(g)= N2(g) + 2H2O △H2= -534.2kJ·mol-1
写出肼和N2H4反应的热化学方程式 ;
(3)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com