
【题目】25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是 ( )
A. 2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2
(aq)+2![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(1)
O(1) ![]() H=
H=![]() 114.6 kJ/mol
114.6 kJ/mol
B. 2KOH(aq)+ H![]() SO4(aq)= K
SO4(aq)= K![]() SO4(aq)+2H
SO4(aq)+2H![]() O(l)
O(l) ![]() H=
H=![]() 114.6kJ/mol
114.6kJ/mol
C. C8H18(l)+ ![]() O
O![]() (g)=8CO
(g)=8CO![]() (g)+ 9H
(g)+ 9H![]() O
O ![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D. 2C8H18(g)+25O![]() (g)=16CO
(g)=16CO![]() (g)+18H
(g)+18H![]() O(1)
O(1) ![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
【答案】B
【解析】
在101kPa时,lmol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热;在稀溶液中,稀的酸跟碱发生中和反应而生成1mo水,这时的反应热叫做中和热。
A.25℃,101k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,所以2H+(aq)+2OH-(aq)=2H2O(l)△H=-114.6kJ/mol,该反应中还有硫酸钡生成,故A错误;B.25℃,101k Pa时,在稀溶液中,酸跟碱发生中和反应而生成1mo水,这时的反应热叫做中和热,△H与物质的量成正比,故B正确;C.该热化学方程式中没有标明水的状态,故C错误;D.燃烧热概念要求必须是lmol物质完全燃烧,即C8H18(g)+![]() O2(g)═8CO2(g)+9H2O(1)△H=-5518kJ/mol,故D错误;故答案为B。
O2(g)═8CO2(g)+9H2O(1)△H=-5518kJ/mol,故D错误;故答案为B。


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。

(1)A中反应的离子方程式为_________________________________。
(2)B中Fe极为_______极,电极反应式为_______________________。C中Fe极为_______极,电极反应式为__________________________,电子从_______极流出(填“Zn”或“Fe”)。
(3)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体并使其发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )

A. 该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B. 0~1 s内,v(A)=v(C)
C. 0~6 s内,B的平均反应速率为0.05 mol·L-1·s-1
D. 0~6 s内,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.Na2O2与H2O反应:2O![]() +2H2O===O2↑+4OH-
+2H2O===O2↑+4OH-
B.向Fe2(SO4)3溶液中加入足量Cu粉:2Fe3++3Cu===2Fe+3Cu2+
C.向NaHSO4溶液中加入Ba(OH)2溶液至中性:2H++SO![]() +Ba2++2OH-===BaSO4↓+2H2O
+Ba2++2OH-===BaSO4↓+2H2O
D.向银氨溶液中加入足量盐酸:[Ag(NH3)2]++2H+===Ag++2NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )

A.图1可表示电解200 mL 0.1 mol·L-1 NaCl溶液过程中,产生氢气体积(标准状况)与转移电子物质的量的关系曲线
B.图2可表示常温下0.1 mol·L-1盐酸滴加到40 mL 0.1 mol·L-1 NaOH溶液的滴定曲线
C.高温下能自发进行的反应CO2(g)+H2(g)![]() CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
CO(g)+H2O(g)的能量变化如图3所示,则该反应的ΔS>0
D.图4可表示反应N2(g)+3H2(g)![]() 2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
2NH3(g)在t1时刻扩大容器体积时,v逆随时间的变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大。A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物是常用的食品调味剂。
回答下列问题:
(1)写出元素D在周期表中的位置____________________________________________。
(2)五种元素中,原子半径最大的是________(填元素符号),非金属最强的是________(填元素符号)。
(3)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是________(用化学式表示)。
(4)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为________,其中存在的化学键类型为_______________和________________。
(5)单质E与水反应的离子方程式为____________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是一种非天然氨基酸,其合成路线如下:
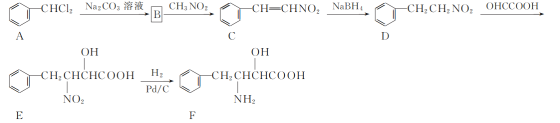
(1) C中官能团的名称为________。
(2) D→E的反应类型为________。
(3) B的分子式为C7H6O,写出B的结构简式:________。
(4) D的一种同分异构体X同时满足下列条件,写出X的结构简式: ________。
①六元环状脂肪族化合物;
②能发生银镜反应,1 mol X反应能生成4 mol Ag;
③分子中只有4种不同化学环境的氢。
(5) 写出以![]() 、CH3NO2为原料制备
、CH3NO2为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干) _____ 。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干) _____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1molSO3(g)的ΔH=-99kJ·mol-1。请回答下列问题:

(1)图中A、C分别表示____,___,E的大小对该反应的反应热__(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点___(填“升高”或“降低”),ΔH___(填“变大”“变小”或“不变”)。
(2)图中ΔH=____kJ·mol-1。
(3)依据事实,写出下列反应的热化学方程式。
①1molN2(g)与适量H2(g)反应,生成NH3(g),放出92.2kJ热量:_____。
②1molCu(s)与适量O2(g)反应,生成CuO(s),放出157kJ热量:_____。
③在25℃、101kPa时,8 g CH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com