
【题目】二氧化碳是一种宝贵的碳氧资源。以CO2和NH3为原料合成尿素是固定和利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) △H1=a kJ·mol-1
NH2CO2NH4(s) △H1=a kJ·mol-1
反应Ⅱ:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ·mol-1
总反应Ⅲ:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1
CO(NH2)2(s)+H2O(g) △H3=-86.98kJ·mol-1
请回答下列问题:
(1)反应Ⅰ的△H1= (用具体数据表示)。
(2)反应Ⅱ的△S (填>或<)0,一般在 情况下有利于该反应的进行。
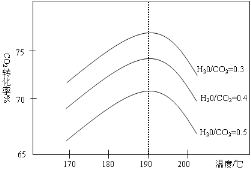
(3)反应Ⅲ中影响CO2平衡转化率的因素很多,下图1为某特定条件下,不同水碳比n(H2O)/n(CO2)和温度影响CO2平衡转化率变化的趋势曲线。
①其他条件相同时,为提高CO2的平衡转化率,生产中可以采取的措施是 (填提高或降低)水碳比。
②当温度高于190℃后,CO2平衡转化率出现如图所示的变化趋势,其原因是 。
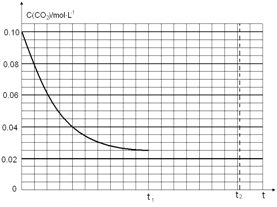
(4)某研究小组为探究反应Ⅰ中影响c(CO2)的因素,在恒温下将0.4molNH3和0.2molCO2放入容积为2L的密闭容器中,t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如上图所示。若其他条件不变,t1时将容器体积压缩到1L,请画出t1后c(CO2)随时间t变化趋势曲线(t2达到新的平衡)。
(5)尿素在土壤中会发生反应CO(NH2)2+2H2O![]() (NH4)2CO3。下列物质中与尿素有类似性质的是
(NH4)2CO3。下列物质中与尿素有类似性质的是
A.NH2COONH4 B.H2NOCCH2CH2CONH2
C.HOCH2CH2OH D.HOCH2CH2NH2
【答案】(1)-159.47 kJmol-1(1分)(2)>(1分) 高温(1分) (3)降低 (1分) 温度高于190℃时,因为反应Ⅲ是放热反应,温度升高平衡向逆方向进行,CO2的平衡转化率降低(2分)
(4)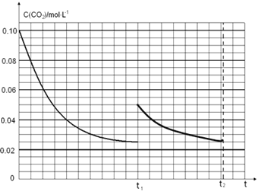 (2分) (5)AB(2分)
(2分) (5)AB(2分)
【解析】
试题分析:(1)反应Ⅰ:2NH3(g)+CO2(g)![]() NH2CO2NH4(s)△H1=a kJ·mol-1
NH2CO2NH4(s)△H1=a kJ·mol-1
反应Ⅱ:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g)△H2=+72.49kJ·mol-1
CO(NH2)2(s)+H2O(g)△H2=+72.49kJ·mol-1
总反应Ⅲ:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)△H3=-86.98kJ·mol-1
CO(NH2)2(s)+H2O(g)△H3=-86.98kJ·mol-1
由盖斯定律可知总反应Ⅲ-反应Ⅱ,得到2NH3(g)+CO2(g)![]() NH2CO2NH4(s)△H1=a=-159.47kJ·mol-1;
NH2CO2NH4(s)△H1=a=-159.47kJ·mol-1;
(2)反应Ⅱ:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g)△H2=+72.49kJ/mol,反应前后气体体积增大,△S>0,焓变分析可知是吸热反应,△H>0,所以依据反应自发进行的判断依据△H-T△S<0,需要在高温下反应自发进行;
CO(NH2)2(s)+H2O(g)△H2=+72.49kJ/mol,反应前后气体体积增大,△S>0,焓变分析可知是吸热反应,△H>0,所以依据反应自发进行的判断依据△H-T△S<0,需要在高温下反应自发进行;
(3)①反应Ⅲ:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)△H3=-86.98kJ·mol-1,其他条件相同时,为提高CO2的平衡转化率,平衡正向进行,依据图象中的水碳比数据分析判断,生产中可以采取的措施是降低水碳比,二氧化碳转化率增大;
CO(NH2)2(s)+H2O(g)△H3=-86.98kJ·mol-1,其他条件相同时,为提高CO2的平衡转化率,平衡正向进行,依据图象中的水碳比数据分析判断,生产中可以采取的措施是降低水碳比,二氧化碳转化率增大;
②反应Ⅲ:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)△H3=-86.98kJ/mol,是放热反应,升温高于190℃,依据图象分析可知,二氧化碳转化率减小,因为温度升高,平衡逆向进行;
CO(NH2)2(s)+H2O(g)△H3=-86.98kJ/mol,是放热反应,升温高于190℃,依据图象分析可知,二氧化碳转化率减小,因为温度升高,平衡逆向进行;
(4)在恒温下将0.4mol NH3和0.2mol CO2放入容积为2L的密闭容器中,达到平衡时,
2NH3(g)+CO2(g)![]() NH2CO2NH4(s)
NH2CO2NH4(s)
起始量(mol·L-1) 0.2 0.1 0
变化量(mol·L-1) 0.15 0.075 0
平衡量(mol·L-1) 0.05 0.025 0
t1时达到平衡过程中c(CO2)随时间t变化趋势曲线如图2所示,若其他条件不变,t1时将容器体积压缩到1L,二氧化碳浓度应增大到0.05mol·L-1,压强增大,平衡正向进行,由于生成物是固体,所以达到平衡状态,二氧化碳浓度保持不变,据此画出变化曲线为:
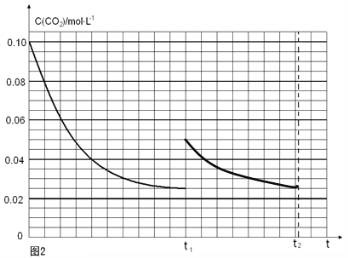 ;
;
(5)尿素在土壤中会发生反应CO(NH2)2+2H2O![]() (NH4)2CO3,分析结构特征可知,物质性质取决于官能团,尿素中氨基和羰基相连和水反应生成铵根离子,所以选项中符合此结果特征的有类似性质:A.NH2COONH4结构中含有与羰基连接的氨基,A符合;B.H2NOCCH2CH2CONH2 结构中含有与羰基连接的氨基,B符合;C.HOCH2CH2OH结构中不含有氨基,C不符合;D.HOCH2CH2NH2分子中的氨基不是和羰基连接,不具备此性质,D不符合;答案选A、B。
(NH4)2CO3,分析结构特征可知,物质性质取决于官能团,尿素中氨基和羰基相连和水反应生成铵根离子,所以选项中符合此结果特征的有类似性质:A.NH2COONH4结构中含有与羰基连接的氨基,A符合;B.H2NOCCH2CH2CONH2 结构中含有与羰基连接的氨基,B符合;C.HOCH2CH2OH结构中不含有氨基,C不符合;D.HOCH2CH2NH2分子中的氨基不是和羰基连接,不具备此性质,D不符合;答案选A、B。


科目:高中化学 来源: 题型:
【题目】下列做法正确的是( )
A. 将浓硝酸保存在无色玻璃瓶中 B. 金属钠和钾保存在煤油中
C. Na2CO3可以保存在玻璃塞的玻璃瓶中 D. NaOH固体放在滤纸上称量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有某混合物的无色透明溶液,可能含有以下离子中的若干种:
Na+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
①第一份加入足量AgNO3溶液有沉淀产生,加足量稀硝酸后沉淀部分溶解;
②第二份加足量NaOH溶液充分加热后,收集到气体0.896L(标准状况);
③第三份加足量BaCl2溶液后,过滤后充分干燥得到沉淀6.27g,再经足量稀硝酸洗涤、干燥后,沉淀质量变为2.33g。根据上述实验现象和有关数据,回答下列问题:
(1)原溶液中一定存在的阴离子是 ,一定不存在的离子是 ,可能存在的离子是 。
(2)②中发生化学反应的离子方程式为 。
(3)③中生成可溶于稀硝酸的沉淀化学式为 ,物质的量为 mol,该沉淀溶于稀硝酸的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾是绿色、环保型水处理剂,也是高能电池的电极材料。工业上,利用硫酸亚铁为原料,通过铁黄(FeOOH)制备高铁酸钾,可降低生产成本且产品质量优。工艺流程如下:
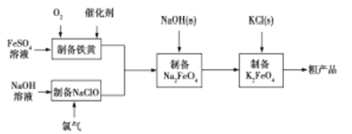
回答下列问题:
(1)有同学认为上述流程可以与氯碱工业联合。写出电解饱和食盐水制取次氯酸钠的化学方程式 。
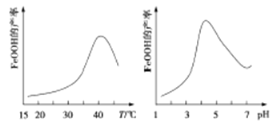
(2)制备铁黄的反应中氧化剂与还原剂的物质的量之比为 。实验测得反应溶液的pH、温度对铁黄产率的影响如图所示。反应温度宜选择 ;pH大于4.5时铁黄产率降低的主要原因可能是 。
(3)用高铁酸钾处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3、CN-等,生成的氢氧化铁胶体粒子还能吸附水中悬浮杂质。试写出高铁酸钾处理含CN-废水时除去CN-的离子方程式 。
(4)K2FeO4可作锌铁碱性高能电池的正极材料,电池反应原理:
2K2FeO4+3Zn+8H2O![]() 2Fe(OH)3+3Zn(OH)2+4KOH。放电时负极材料是 ;充电时阳极的电极反应式为 。
2Fe(OH)3+3Zn(OH)2+4KOH。放电时负极材料是 ;充电时阳极的电极反应式为 。
(5)已知:常温下,Kap[Fe(OH)3]=4.0×10-38。高铁酸钾的净水能力与废水的pH有关,当溶液pH=2时,废水中c(Fe3+)= mol·L-1。
(6)如果上述流程中,铁元素总利用率为75%。利用1mol 2mol·L-1FeSO4溶液能制备纯度为90%的高铁酸钾 kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)常作火箭发射的推进剂。已知NH4ClO4在400℃时开始分解。某课题组设计实验探究NH4ClO4的分解产物(假设装置内药品均足量)。
(1)甲同学设计如图实验(部分夹持装置已省略):
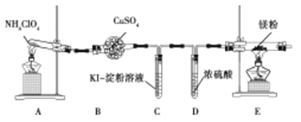
①若高氯酸铵分解有氯气生成,则可能观察到的现象是 ,写出产生该现象的离子方程式 。
②实验完毕后,取出E中硬质玻璃管中固体于试管中,滴加蒸馏水,产生的气体R能使红色湿润的石蕊试纸变蓝色。R的电子式为 。硬质玻璃管中固体与水反应放出R的化学方程式为 。
(2)乙同学认为,A中可能产生O2。为了验证他的猜想,选择上述部分装置和下列提供的装置进行实验:
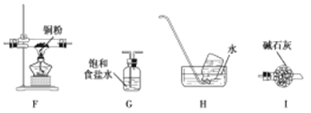
①按气流从左至右,装置的连接顺序为 。
②能说明有氧气的现象是 。
(3)通过查阅资料:NH4ClO4在℃时的分解产物为N2、Cl2、O2、H2O,写出高氯酸铵分解的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存并且溶液为无色透明的离子组是( )
A、Ca2+、Na+、NO3-、CO32- B、Mg2+、C1-、NH4+、SO42-
C、K+、Cl-、HCO3-、NO3- D、Ca2+、Na+、Fe2+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
元素A、B、C、D、E、F、G在元素周期表中的位置如下图所示,回答下列问题:

(1)G的基态原子核外电子排布式为________。原子的第一电离能:D________E(填“>”或“<”)。
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l-l > l-b > b-b(l为孤对电子对,b为键合电子对),则关于A2C中的A-C-A键角可得出的结论是________。
A.180° B.接近120°,但小于120°
C.接近120°,但大于120° D.接近109°28’,但小于109°28’
(3)化合物G(BC)5的熔点为-20℃,沸点为103℃,其固体属于________晶体,该物质中存在的化学键类型有________,它在空气中燃烧生成红棕色氧化物,反应的化学方程式为________。
(4)化合物BCF2的立体构型为________,其中B原子的杂化轨道类型是________,写出两个与BCF2具有相同空间构型的含氧酸根离子________。
(5)化合物EC的晶胞结构如图所示,晶胞参数a=0.424nm。每个晶胞中含有___________个E2+,列式计算EC晶体的密度(g·cm-3)______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________(写出名称)。
氟 | 氯 | 溴 | 碘 | |
第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图I、II所示:
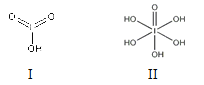
请比较二者酸性强弱:HIO3________H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(6)右图为碘晶体晶胞结构。有关说法中正确的是_________。
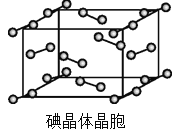
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(见右图)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
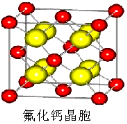
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。
请回答下列问题:
(1)X元素原子基态时的电子排布式为______________,该元素的符号是________;
(2)Y元素原子的价层电子的电子排布图为____________________,该元素的名称是________;
(3)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(4)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性,并说明理由_____________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com