
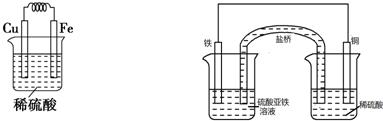
 ,负极铁被氧化生成Fe2+,正极H+被还原生成H2,正极反应为2H++2e-→H2↑,负极反应为
,负极铁被氧化生成Fe2+,正极H+被还原生成H2,正极反应为2H++2e-→H2↑,负极反应为 ;2H++2e-=H2↑;Fe=Fe2++2e-;
;2H++2e-=H2↑;Fe=Fe2++2e-;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、1:1 | B、2:3 |
| C、3:2 | D、3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | |
| Y | Z |
| A、X的气态氢化物热稳定性强于Z的气态氢化物 |
| B、原子半径:X<Y<Z |
| C、若Y的最高正价为+m,则X,Z的最高正价一定为+(m+1) |
| D、Y和Z的最高价氧化物对应水化物酸性Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、属于置换反应 |
| B、还原性:H2O>H2S |
| C、氧化性:O2>S |
| D、酸性:H2S>H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
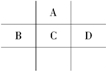 有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同.
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同.查看答案和解析>>
科目:高中化学 来源: 题型:
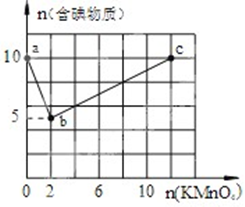 实验一:向含10mol KI的硫酸溶液中逐滴加入高锰酸钾溶液.整个过程中含碘物质与加入高锰酸钾的物质的量的关系如图,已知酸性条件下MnO4-转变为Mn2+.
实验一:向含10mol KI的硫酸溶液中逐滴加入高锰酸钾溶液.整个过程中含碘物质与加入高锰酸钾的物质的量的关系如图,已知酸性条件下MnO4-转变为Mn2+.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
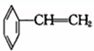 ②
② ③
③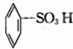 ④
④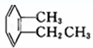 ⑤
⑤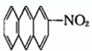
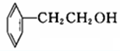 ⑦
⑦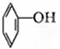 ⑧CH3CH=CH-COOH⑨
⑧CH3CH=CH-COOH⑨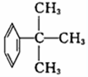
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com