
| A. | 从碘水中萃取碘单质,可用苯做萃取剂 | |
| B. | 用加热分解的方法可以区别碳酸钠和碳酸氢钠两种固体 | |
| C. | 配制一定物质的量浓度的NaCl溶液时,只需使用1次玻璃棒 | |
| D. | 氨气喷泉实验时,烧瓶必须干燥才可收集 |
分析 A.苯与水不互溶,且碘不易溶于水,易溶于苯;
B.加热碳酸氢钠分解;
C.配制溶液,溶解时需要玻璃棒搅拌,转移液体需要玻璃棒引流;
D.因氨气极易溶于水,烧瓶必须干燥才可收集.
解答 解:A.苯与水不互溶,且碘不易溶于水,易溶于苯,则从碘水中萃取碘单质,可用苯做萃取剂,故A正确;
B.加热碳酸氢钠分解,而碳酸钠不分解,则用加热分解的方法可以区别碳酸钠和碳酸氢钠两种固体,故B正确;
C.配制溶液,溶解时需要玻璃棒搅拌,转移液体需要玻璃棒引流,则需要2次玻璃棒,故C错误;
D.因氨气极易溶于水,烧瓶必须干燥才可收集,可使烧瓶收集满氨气,故D正确;
故选C.
点评 本题考查物质的鉴别、混合物分离提纯及喷泉实验等,为高考中常见的冷拼凑试题,把握物质的性质、混合物分离提纯实验、性质实验等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
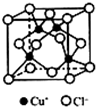 I.下表是A、B、C、D、E五种短周期元素的某些性质:
I.下表是A、B、C、D、E五种短周期元素的某些性质:| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| X | Y | Z | |
| 第一电离能/(kJ/mol) | 520.2 | 495.8 | 418.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
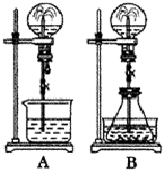 喷泉实验是一种常见的自然现象,其产生原因是存在压强差.试根据下图,回答下列问题:
喷泉实验是一种常见的自然现象,其产生原因是存在压强差.试根据下图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入BaCl2溶液,出现白色沉淀,再加稀硝酸溶液,若沉淀不溶解,则该溶液中肯定有SO42- | |
| B. | 灼烧某白色粉末,火焰呈黄色,则证明原粉末中肯定有Na+,无K+ | |
| C. | 向某溶液中滴加AgNO3溶液后,出现白色沉淀,再加稀盐酸,若沉淀不溶解,则证明溶液中肯定有Cl- | |
| D. | 在某盐溶液中加入氢氧化钠浓溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则该溶液中肯定有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
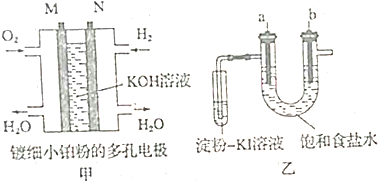
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4与Ba(OH)2溶液反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 向Na2CO3溶液中通入少量CO2:CO32-+CO2+H2O═2HCO3- | |
| D. | CH3COOH溶液与NaOH溶液反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
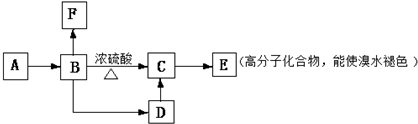
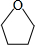 ,
,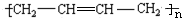 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2是氧化剂 | B. | I2是还原产物 | ||
| C. | 上述反应属于置换反应 | D. | 上述反应属于离子反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com