
| A、明矾可作净水剂 |
| B、CaCO3是陶瓷的主要成分 |
| C、干冰能用作于人工降雨 |
| D、NaHCO3可作抗酸药,能中和胃里过多的酸,缓解胃部不适 |


科目:高中化学 来源: 题型:
| 实验序号 | 加入盐酸体积/mL | 剩余固体质量/g |
| 1 | 10 | 1.8 |
| 2 | 20 | 1.1 |
| 3 | 30 | 0.5 |
| 4 | 50 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,48gO3和48gO2含有的氧原子数均为3NA |
| B、1.8g的NH4+离子中含有的电子数为0.1NA |
| C、11.2L氧气中所含有的原子数为NA |
| D、标准状况下,22.4 L水所含分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
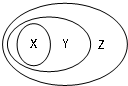 用如图表示的一些物质或概念间的从属关系中不正确的是( )
用如图表示的一些物质或概念间的从属关系中不正确的是( )| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 甲烷 | 烷烃 | 烃 |
| B | 胶体 | 分散系 | 混合物 |
| C | 电解质 | 离子化合物 | 化合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
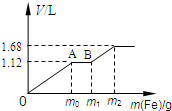 向50mL 稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如右图所示,且每一段只对应一个反应.下列说法正确的是( )
向50mL 稀H2SO4与稀HNO3的混合溶液中逐渐加入铁粉,假设加入铁粉的质量与产生气体的体积(标准状况)之间的关系如右图所示,且每一段只对应一个反应.下列说法正确的是( )| A、产生氢气的体积为1.68L |
| B、产生二氧化氮的体积为1.12L |
| C、参加反应铁粉的总质量m2=5.6g |
| D、原混合溶液中c(HNO3)=0.5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
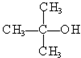 ③
③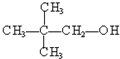 ④
④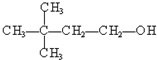 ⑤
⑤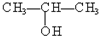
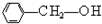 )
)查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com