


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
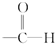
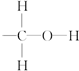
查看答案和解析>>
科目:高中化学 来源: 题型:
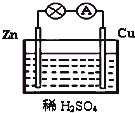 如图为原电池的示意图.请回答:
如图为原电池的示意图.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定序号 | 待测液体体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 起始读数 滴定前 | 终点读数 | ||
| 1 | 20.00 | O.50 | 20.40 |
| 2 | 20.00 | 6.OO | 26.10 |
| 3 | 20.00 | 4.OO | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
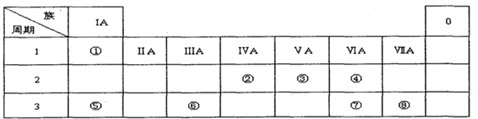
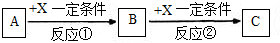
查看答案和解析>>
科目:高中化学 来源: 题型:
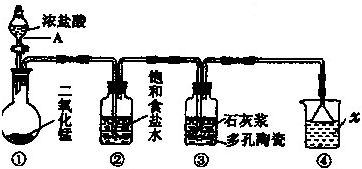
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl2溶液中通入Cl2:2Fe2++Cl2=2Fe3++2Cl- |
| B、澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-=CaCO3↓+H2O |
| C、FeS固体放人稀硝酸溶液中:FeS+2H+=Fe2++H2S↑ |
| D、AlCl3溶液中加入过量氨水:Al3++3OH-=Al(OH)3-↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com