
| A. | 原子半径:r(W)>r(Z)>r(Y) | |
| B. | Z的最高价氧化物对应水化物的碱性比W的强 | |
| C. | 化合物X2Y2和Z2Y2所含化学键类型完全相同 | |
| D. | 工业上常用电解熔融W的氧化物制备W的单质 |
分析 Y原子最外层电子数是其内层电子总数的3倍,应为O元素,X的原子半径比Y的小,且原子序数比Y小,则X应在Y的上一周期,应为H元素,X和Z同主族,则Z为Na元素,W原子的核电荷数等于X、Z原子的核电荷数之和,应为Mg元素,以此解答该题.
解答 解:X为H、Y为O、Z为Na、W为Mg.
A.同周期元素从左到右原子半径减小,应为Na>Mg,故A错误;
B.金属性Na>Mg,元素的金属性越强,对应的最高价氧化物对应水化物的碱性越强,故B正确;
C.化合物H2O2含有共价键,Na2O2含共价键和离子键,化学键类型不同,故C错误;
D.MgO熔点较高,一般用电解氯化镁的方法冶炼镁,故D错误.
故选B.
点评 本题考查结构性质与位置关系、元素周期律等知识,为高频考点,题目难度中等,推断元素是解题的关键,注意明确原子结构与元素周期律之间的关系,试题培养了学生的分析能力及灵活应用能力.


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:推断题
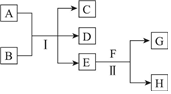 A~H为中学化学中几种常见物质,它们之间的转化关系如图所示.常温下,A和G均为单质气体,同体C常用作干燥剂,E为无色、无味的液体,F为淡黄色粉末.回答下列问题:
A~H为中学化学中几种常见物质,它们之间的转化关系如图所示.常温下,A和G均为单质气体,同体C常用作干燥剂,E为无色、无味的液体,F为淡黄色粉末.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q、R的最高价氧化物对应水化物间可反应 | |
| B. | Y的简单氢化物比Z的简单氢化物稳定 | |
| C. | 可通过电解熔融氯化物的方法制备Q、R | |
| D. | X元素单质在化学反应中只表现还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
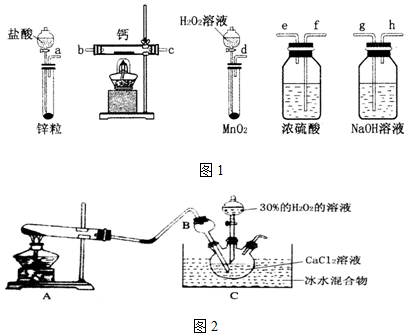
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基丁烷也称异丁烷 | |
| B. | 乙烯、苯都能发生加成反应 | |
| C. | 乙烯、聚氯乙烯分子中都含有碳碳双键 | |
| D. | 淀粉、油脂、蛋白质都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
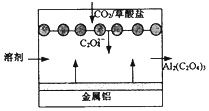
| A. | 该装置是将电能转变为化学能 | |
| B. | 正极的电极反应为:C2O42--2e-=2CO2 | |
| C. | 每得到1 mol草酸铝,电路中转移3 mol电子 | |
| D. | 利用该技术可捕捉大气中的CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 乙烯是石油化工的重要产品,以乙烯为原料制备一些化工产品的流程如图:
乙烯是石油化工的重要产品,以乙烯为原料制备一些化工产品的流程如图: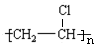
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 共价化合物中只含共价键 | |
| B. | 离子化合物中可能含有共价键 | |
| C. | 干冰变为二氧化碳气体,因共价键被破坏需吸收能量 | |
| D. | 碳酸氢铵受热分解产生氨气不仅破坏离子键还破坏了共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com