
【题目】今有一包铁粉和铜粉混合粉末,为确定其组成,现提供4mol/L的FeCl3溶液(其他用品略),某合作学习小组同学的实验结果如下(假定反应前后溶液体积不变)( )
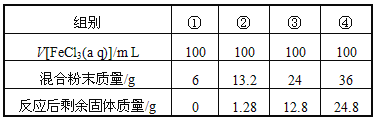
A. 第①组充分反应后溶液中c(Fe3+)=2.0 mol/L
B. 第②组剩余固体是铜铁混合物
C. 第④组反应后的滤液中c(Fe2+)=5 mol/L
D. 原混合粉末中n(Fe):n(Cu)=2:3
【答案】A
【解析】由②组数据得出,FeCl3溶液全部参与反应,设只发生第一个反应,则溶解的Fe为11.2g,13.2-1.28=11.92>11.2,同时也有一部分Cu溶解,剩余的固体全部为Cu;利用②的数据,设Cu、Fe合金中金属物质的量分别为xmol、ymol,100mL中Fe3+的物质的量为0.1L×4mol·L-1=0.4mol,
Fe+2Fe3+=3Fe2+
x 0.2x
Cu + 2Fe3+=Cu2++2Fe2+
0.2-0.1x 0.4-0.2x
依据铜元素守恒可得:(0.2-0.1x)+1.28g/64=y,根据质量守恒可得:56x+64y=13.2,联立解得:x=y=0.11,即铜与铁物质的量比是1:1,验证:利用③的数据,正好是24-11.2=12.8,只发生了Fe+2Fe3+═3Fe2+,剩余的12.8全部为Cu,所以n(Fe):n(Cu)=(11.2g/56g·mol-1):(1.28g/64g·mol-1)=1:1,符合铁和铜的物质的量之比的判断;①组,6g固体中含有Cu、Fe的物质的量各为0.05mol
Fe+2Fe3+=3Fe2+
0.05 0.1 0.15
Cu+2Fe3+=Cu2++2Fe2+
0.05 0.1 0.05 0.1
c(Fe3+)=(0.4mol-0.2mol)/0.1L=2.0mol·L-1,
④组中铁和铜物质的量按照1:1混合,可以计算得到铁和铜的物质的量都为:36g/(56+64)g·mol-1=0.3mol,36g金属中铁的质量为:0.3mol×56g·mol-1=16.8g,铜的质量为19.2g;依据反应Fe+2Fe3+=3Fe2+,有三价铁离子物质的量计算判断,反应金属为11.2g铁,所以剩余固体为铁和铜,三价铁全部反应,根据铁元素守恒可知,0.4molFe3+全部反应生成Fe2+,溶解的铁为11.2g,物质的量为:11.2g/56g·mol-1=0.2mol,所以反应后溶液中Fe2+的浓度为:c(Fe2+)=(0.2mol+0.4mol)/0.1L=6mol·L-1,
A、第①组溶液中c(Fe3+)=2.0mol·L-1,故A正确;B、第②、③组剩余固体全是铜,故B错误;C、第④组反应后的滤液中c(Fe2+)=6mol·L-1,故C错误;D、原混合粉末中n(Fe):n(Cu)=1:1,故D错误;故选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】白磷与氧可发生如下反应:P4+5O2═P4O10 . 已知断裂下列化学键需要吸收的能量分别为:P﹣P:a kJmol﹣1、P﹣O:b kJmol﹣1、P=O:c kJmol﹣1、O=O:d kJmol﹣1 . 根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( ) 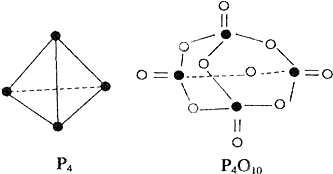
A.(6a+5d﹣4c﹣12b)kJmol﹣1
B.(4c+12b﹣6a﹣5d)kJmol﹣1
C.(4c+12b﹣4a﹣5d)kJmol﹣1
D.(4a+5d﹣4c﹣12b)kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( ) 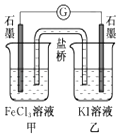
A.金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关
B.标准状况下,2.24LCCl4分子中共价键的数目为0.4×6.02×1023
C.控制适合的条件,将反应2Fe3++2I﹣═2Fe2++I2设计成如图所示的原电池.当电流汁读数为零后,在甲中溶入FeCl2固体,则乙中石墨电极为负极
D.向盛有2mL饱和H2S溶液的两支试管中分别滴加1滴浓度均为0.1mol/L的ZnSO4溶液和CuSO4溶液,有CuS生成而无ZnS生成,则Ksp(CuS)<Ksp(ZnS)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z,W均为短周期元素,它们在元素周期表中的位置如下图所示.若Y原子的最外层电子数是次外层电子数的2倍,下列说法中正确的是( ) ![]()
A.氢化物稳定性:X>Y
B.最高价氧化物对应的水化物的酸性:W>Y
C.4种元素的单质中,W单质的熔、沸点最高
D.干燥的W单质具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式为:
1)C(s)+O2(g)=CO2(g)△H1=﹣393.5kJ/mol
2)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H2=﹣870.3kJ/mol
3)H2(g)+ ![]() O2(g)=H2O(l)△H3=﹣285.8kJ/mol
O2(g)=H2O(l)△H3=﹣285.8kJ/mol
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l) 的反应热(焓变)为( )
A.+488.3kJ/mol
B.﹣488.3kJ/mol
C.﹣244.15kJ/mol
D.+244.15kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.![]() =1×10﹣13mol?L﹣1的溶液中:Na+、K+、AlO2﹣、NO3﹣
=1×10﹣13mol?L﹣1的溶液中:Na+、K+、AlO2﹣、NO3﹣
B.含有大量Fe3+的溶液中:NH4+、I﹣、Cl﹣、K+
C.pH=7的溶液中:NH4+、Al3+、SO42﹣、NO3﹣
D.0.1mol?L﹣1Na2SO3的溶液中:H+、Ca2+、Fe2+、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物.
(1)冶炼铜的反应为:8CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16SO2。若CuFeS2中Fe的化合价为+2,反应中被还原的元素是________(填元素符号).若反应中生成了标况下22.4L气体,转移的电子数目为________。
(2)上述冶炼过程产生大量酸性氧化物SO2,为大气污染物之一。下列处理方案中合理的是________(填代号).
a.高空排放 b.用浓硫酸氧化吸收制硫酸
c.用NaOH溶液吸收制Na2SO3 d.用氨水吸收制氮肥铵盐
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O![]() +2I-=2SO
+2I-=2SO![]() +I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程.________、________(不必配平)。
+I2。通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程.________、________(不必配平)。
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
据以上信息回答下列问题:
a.除去Al3+的离子方程式是________.
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水 所选试剂为________.证明炉渣中含有FeO的实验现象为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)(1)用胆矾(CuSO4·5H2O)配制0.200mol/L CuSO4溶液240mL,所需要的玻璃仪器为:烧杯、量筒、________________________(要填全),应称取胆矾的质量为____________。
(2)下列操作使所配CuSO4溶液浓度偏低的是____________。
A.观察刻度线时仰视
B.观察刻度线时俯视
C.定容后倒转容量瓶几次,发现液面最低点低于标线,再补几滴水至标线
D.配制溶液前,容量瓶中有少量蒸馏水
(二)(1)用单线桥标出该反应的电子转移方向和数目,并回答相关问题:
KClO4+8HCl(浓)=KCl+4Cl2↑+4H2O____________,氧化剂与还原剂的物质的量之比为____________。
(2)配平化学方程式(将化学计量数填于空白处)
_____KMnO4+___FeSO4+___H2SO4=___K2SO4+__MnSO4+__Fe2(SO4)3+__H2O
氧化产物与还原产物的物质的量比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下物质之间的每步转化中,都能通过一步实现的是( )
①Fe→FeCl2→Fe(OH)2→ Fe(OH)3
②Na→Na2O→Na2CO3→NaHCO3→NaOH
③Mg→MgCl2→Mg(OH)2
④Al→Al2O3→Al(OH)3
⑤Al→NaAlO2→Na2CO3
A. ②③④ B. ①③④⑤ C. ①②③⑤ D. ①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com