
分析 用惰性电极电解AgNO3溶液,溶液中的阴离子在阳极放电,阴极离子的放电顺序为氢氧根离子>硝酸根离子;溶液中的阳离子在阴极的放电,放电顺序为银离子>氢离子,则4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,根据电子守恒进行计算即可.
解答 解:用惰性电极电解AgNO3溶液,溶液中的阴离子在阳极放电,阴极离子的放电顺序为氢氧根离子>硝酸根离子;溶液中的阳离子在阴极的放电,放电顺序为银离子>氢离子,则4AgNO3+2H2O$\frac{\underline{\;通电\;}}{\;}$4Ag+O2↑+4HNO3,阳极为4OH--4e-═O2↑+2H2O,阴极为Ag++e-═Ag,当阴极质量增加1.08g时,转移电子是0.01mol,阳极上产生氧气体积是$\frac{0.01mol}{4}×22.4L/mol$=0.056L,产生的Ag是0.01mol,u总反应,产生的硝酸是0.01mol,溶液中H+的浓度是$\frac{0.01mol}{0.1L}$=0.1mol/L,
答:阳极产生的气体体积(标况下)是0.056,溶液中H+的浓度是0.1mol/L.
点评 本题考查电解原理,明确电子守恒及离子的放电顺序是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 属于有热量放出的反应的是②③ | B. | 属于化合反应的是①② | ||
| C. | 属于有化合价变化的反应是④⑤ | D. | 属于复分解反应的是③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测定某溶液的pH | |
| B. | 用25 mL碱式滴定管量取14.80 mL 1 mol/L NaOH溶液 | |
| C. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 | |
| D. | 用托盘天平称取25.20 gNaCl固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
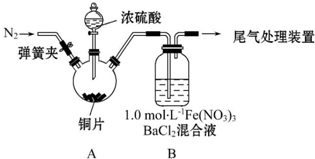
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 | |
| B. | 2p轨道上只有一个成单电子的X原子与3p轨道上只有一个成单电子的Y原子 | |
| C. | 2p轨道上有一个空轨道的X原子与3p轨道上有一个空轨道的Y原子 | |
| D. | 最外层都只有1个电子的X、Y原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 据反应3NO2+H2O═2HNO3+NO可知,NO2是HNO3的酸酐 | |
| B. | 据反应2NO2(g)?N2O4(g)△<0可知要制得较纯净的NO2,需高温、低压环境 | |
| C. | 据反应Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O和3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,可知浓HNO3的氧化性不如稀HNO3强 | |
| D. | NO2、Br2(g)同为红棕色气体,可用湿润的淀粉-KI试纸鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com