
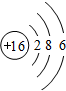 ,故它在周期表的位置是第三周期第ⅥA族,它对应形成的阴离子结构示意图为
,故它在周期表的位置是第三周期第ⅥA族,它对应形成的阴离子结构示意图为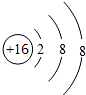 .该元素的最高正化合价为+6,最低负化合价为-2.
.该元素的最高正化合价为+6,最低负化合价为-2.分析 (1)元素周期表16号元素是S元素,原子核外有3个电子层,最外层有6个电子,位于周期表第三周期ⅥA族,可得到2个电子达到稳定结构;
(2)碱金属元素从上到下元素的金属性逐渐增强,半径逐渐增大.
解答 解:(1)元素周期表16号元素是S元素,原子核外有3个电子层,最外层有6个电子,原子结构示意图为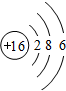 ,最高正价为+6价,最低化合价为-2价,位于周期表第三周期ⅥA族,可得到2个电子达到稳定结构,离子的结构示意图为
,最高正价为+6价,最低化合价为-2价,位于周期表第三周期ⅥA族,可得到2个电子达到稳定结构,离子的结构示意图为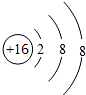 ,
,
故答案为:S;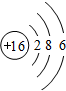 ;三;ⅥA;
;三;ⅥA;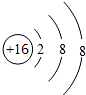 ;+6;-2;
;+6;-2;
(2)碱金属元素从上到下元素的金属性逐渐增强,半径逐渐增大,则元素周期表中碱金属元素半径最小的是Li,金属性最强的是Cs,故答案为:Li;Cs.
点评 本题考查原子结构与元素周期率、周期表等问题,为高频考点,侧重于双基的考查,注意把握原子结构与元素周期表的关系,难度不大.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:解答题
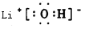 .
.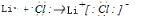
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钠的金属性比钾强 | |
| B. | 溴的非金属性比氯强 | |
| C. | IIA族中原子半径最小的是铍 | |
| D. | 第二周期中,除稀有气体元素外原子半径最大的是锂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
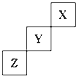 短周期元素X、Y、Z在周期表中位置关系如图所示,
短周期元素X、Y、Z在周期表中位置关系如图所示, .写出Z单质与铁反应的化学反应方程式:Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS.
.写出Z单质与铁反应的化学反应方程式:Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石比石墨更稳定 | |
| B. | 石墨比金刚石更稳定 | |
| C. | 1 mol金刚石比1 mol石墨的总能量低 | |
| D. | 1 mol金刚石转变为石墨需要吸收1.895 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
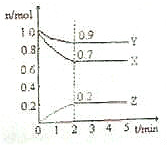 在一定条件下,N2(g)+H2(g)?2NH3(g),该反应的能量变化为放出92.4KJ热量,在容积为2升的密闭容器中,分别充入1molN2和1molH2,2min反应达到最大限度,三种气态物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
在一定条件下,N2(g)+H2(g)?2NH3(g),该反应的能量变化为放出92.4KJ热量,在容积为2升的密闭容器中,分别充入1molN2和1molH2,2min反应达到最大限度,三种气态物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
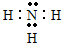 ,
,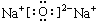 (或
(或 ).
).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com