
| A. | 油脂、糖类、蛋白质均能在一定条件下发生水解反应 | |
| B. | 乙烯能使溴水、高锰酸钾酸性溶液褪色,且褪色原理相同 | |
| C. | 棉、麻、羊毛、蚕丝均属于天然高分子材料 | |
| D. | 石油的分馏与煤的干馏主要是通过物理变化得到成分不同的有机物 |
分析 A.单糖不能水解;
B.乙烯与溴水发生加成反应,乙烯与高锰酸钾发生氧化反应;
C.棉、麻的成分为纤维素,羊毛、蚕丝的成分为蛋白质;
D.煤的干馏为煤在隔绝空气条件下发生的复杂物理化学变化.
解答 解:A.单糖不能水解,油脂、糖类(单糖除外)、蛋白质均能在一定条件下发生水解反应,故A错误;
B.乙烯与溴水发生加成反应,乙烯与高锰酸钾发生氧化反应,反应原理不同,故B错误;
C.棉、麻的成分为纤维素,羊毛、蚕丝的成分为蛋白质,则均属于天然高分子材料,故C正确;
D.煤的干馏为煤在隔绝空气条件下发生的复杂物理化学变化,而石油的分馏与混合物沸点有关,为物理变化,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见有机物的组成和性质、有机反应等,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 装置 | 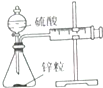 |  |  | 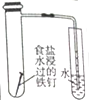 |
| 实验 | 结合秒表测量锌与硫酸的反应速率 | 石油的分馏 | 验证化学能转化为电能 | 铁的吸氧腐蚀实验 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
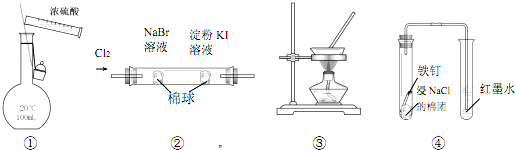
| A. | 图①装置可用于配制 100 mL 0.1 mol/L的硫酸 | |
| B. | 图②装置可证明氧化性:Cl2>Br2>I2 | |
| C. | 图③装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. | 图④装置可观察铁的吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
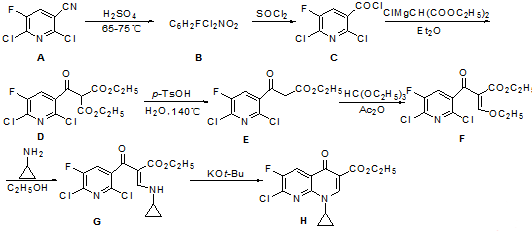
 .由C→D的反应类型是取代反应.
.由C→D的反应类型是取代反应. (其中一种).
(其中一种).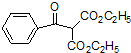 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
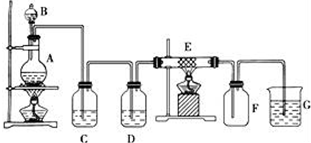
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
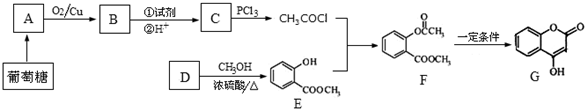
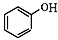 +NaOH→
+NaOH→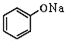 +H2O
+H2O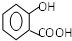 .
. 、CH3COONa、CH3OH.
、CH3COONa、CH3OH.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 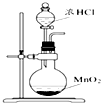 可用装置甲制取氯气 | |
| B. | 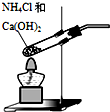 可用装置乙制取氨气 | |
| C. | 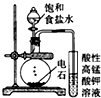 可用装置丙制取并检验乙炔(乙炔中含有H2S、PH3) | |
| D. | 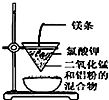 可用装置丁制得金属锰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 尿素CO(NH2)2是一种氮肥 | |
| B. | 储存碳酸氢铵时,应密封并置于阴凉通风处 | |
| C. | 铵态氮肥不能与碱性物质如草木灰等混合施用 | |
| D. | 氮肥溶于水,其中的氮元素均以铵离子形式在存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com