
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
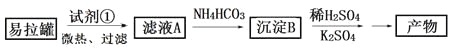
(1)为尽量少引入杂质,试剂①应选用___(填标号)。
a.HCl溶液 b.H2SO4溶液 c.氨水 d.NaOH溶液
(2)易拉罐溶解过程中主要反应的化学方程式为________。
(3)沉淀B的化学式为________;将少量明矾溶于水,溶液呈弱酸性,其原因是__________。
(4)已知:Kw=1.0×10-14,Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于_________。
【答案】(1)d (2分)
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑ (2分)
(3)Al(OH)3Al3+水解,使溶液中H+浓度增大(每空1分,共2分)
(4)20 (2分)
【解析】试题分析:(1)易拉罐(主要成分为Al,含有少量的Fe、Mg杂质),它们都是比较活泼的金属,都可以与酸发生反应,而Al可以与强碱溶液反应变为NaAlO2进入溶液,而Fe、Mg不能与碱发生反应,所以要以含Al的易拉罐为原料制取明矾,应该用强碱NaOH溶液溶解,选项d正确;Mg、Fe不溶解,会留在滤渣中;(2)易拉罐溶解过程中主要反应的化学方程式为2Al+2NaOH+2H2O==2NaAlO2+3H2↑,反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑;(3)滤液A的主要成分是NaAlO2,向其水溶液中加入NH4HCO3溶液,AlO2-、NH4+发生盐的双水解反应,产生Al(OH)3沉淀和NH3·H2O,反应的方程式是AlO2-+2H2O+NH4+= Al(OH)3↓+NH3·H2O,所以沉淀B化学式为Al(OH)3;将少量明矾溶于水,溶液呈弱酸性,其原因是该盐是强酸弱碱盐,Al3+发生水解反应,消耗水电离产生的OH-,当最终达到平衡时溶液中c(H+)>c(OH-),所以溶液显酸性。(4)已知:Kw=1.0×10-14,Al(OH)3![]() AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数K=
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数K= 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如右图所示。下列说法正确的是

A.铁是阳极,电极反应为Fe-2e-+2OH-![]() Fe(OH)2
Fe(OH)2
B.电解一段时间后,镍电极附近溶液的pH减小
C.若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42-
D.每制得1mol Na2FeO4,理论上可以产生67.2L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器的性能或者使用方法的说明中正确的是
A.试管、蒸发皿既能用于给固体加热也能用于给溶液加热
B.分液漏斗既能用于某些混合物的分离也能用于组装气体发生器
C.碱式滴定管既可用于中和滴定,也可用于量取一定量的NaCl或AlCl3溶液
D.测量酒精沸点的实验中,应使温度计水银球位于被加热的酒精中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A.550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届邯郸一模】碳铵是一种较常使用的化肥,它在常温下易分解。某化学兴趣小组对碳铵的成分存在疑问,时行了如下探究。
【定性实验】检验溶液中的阴、阳离子
取少量固体放入试管中,加入盐酸,把生成的气体通入澄清石灰水中,有白色沉淀生成.再另取少量碳铵放入试管中,加入浓NaOH溶液,加热,用湿润的红色石蕊试纸检验生成的气体,石蕊试纸变蓝色。
(1)根据实验现象,推测碳铵中所含有阴离子可能是_______和_______;
(2)根据实验现象,碳铵与足量NaOH溶液加热反应的离子方程式可能是__________________;
【定量试验】测定碳铵中C元素和N元素质量比.该兴趣小组准确称取ag碳铵,加热使之分解,并把产物通入碱石灰中,如图所示.
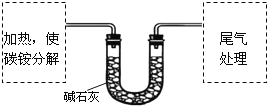
(3)碳铵固体应放在________中进行加热.
A.试管 B.蒸发皿 C.烧瓶 D.坩埚
(4)从安全的角度考虑,尾气处理的装置可以选用________;
(5)若灼烧后没有固体残余,称量U形管在实验前后的质量差为bg.由此测得N元素的质量是_____g。
(6)为了测定碳铵中碳元素的质量,他们设计的实验方案是将ag碳铵完全溶解于水,加入过量BaCl2,然后测定生成沉淀质量.请你评价该方案是否合理;_______(填“合理”“不合理”),理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数为x的元素R。在周期表中位于A,B,C,D 4种元素的中间。A,B,C,D 4种元素的原子序数之和不可能为
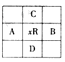
A. 4x B. 4x+10 C. 4x+5 D. 4x+14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.组成上相差一个或若干个CH2原子团,且符合同一通式的有机物之间互称为同系物
B.由于苯分子结构的特殊性,因此苯不能发生加成反应
C.淀粉、纤维素、天然油脂等都属于混合物
D.丙烷分子中所有原子不在一个平面上,但3个碳原子在一直线上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气含氮氧化物(NOX)、碳氢化合物(CXHY)、碳等,直接排放容易造成“雾霾”。因此,不少汽车都安装尾气净化装置(净化处理过程如图)。下列有关叙述,错误的是( )

A.尾气造成“雾霾”与汽油未充分燃烧有关
B.尾气处理过程,氮氧化物(NOX)被还原
C.Pt-Rh催化剂可提高尾气净化反应的平衡转化率
D.使用氢氧燃料电池作汽车动力能有效控制雾霾
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com