
【题目】
废旧可充电电池主要含有Fe、Ni、Cd、Co等金属元素,一种混合处理各种电池回收金属的新工艺如下图所示。
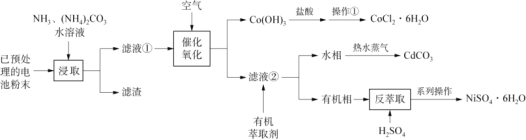
已知:Ⅰ.滤液①中含有Ni(NH3)62+、Cd(NH3)42+、Co(NH3) 62+等物质。
Ⅱ.萃取和反萃取的反应原理分别为:
Ni(NH3)62++ 2HR![]() NiR2+2NH4++4NH3 ;NiR2+2H+
NiR2+2NH4++4NH3 ;NiR2+2H+![]() Ni2+ +2HR
Ni2+ +2HR
(1)为了加快浸取速率,可采取的措施为__________(任写一条)。
(2)已知浸取过程中NH3和NH4+的物质的量之和与Ni、Cd、Co浸取率的关系如表2所示。
表2 浸取过程中氨总量与各离子浸取率的关系
编号 | n(NH3)+ n(NH4+)/mol | Ni浸取率/% | Cd浸取率/% | Co浸取率/% |
① | 2.6 | 97.2 | 88.6 | 98.1 |
② | 3.5 | 86.0 | 98.8 | 86.7 |
③ | 4.8 | 98.4 | 98.8 | 94.9 |
④ | 5.6 | 97.7 | 85.1 | 96.8 |
⑤ | 9.8 | 95.6 | 84.1 | 96.1 |
则可采用的最佳实验条件编号为_____。
(3)Co(OH)3与盐酸反应产生气体单质,该反应的化学方程式______。
(4)操作①的名称为_________、过滤、洗涤。
(5)向有机相中加入H2SO4能进行反萃取的原因为_______(结合平衡移动原理解释)。
(6)将水相加热并通入热水蒸气会生成CdCO3沉淀,并产生使红色石蕊试纸变蓝的气体,该反应的离子方程式为___。
(7)上述工艺流程中可能循环使用的物质为______。
(8)已知Ksp(CdCO3)=1.0×10-12,Ksp(NiCO3)=1.4×10-7。若向物质的量浓度均为0.2mol/L的Cd2+和Ni2+溶液中滴加Na2CO3溶液(设溶液体积增加1倍),使Cd2+恰好沉淀完全,即溶液中c(Cd2+)=1.0×10-5mol/L时,是否有NiCO3沉淀生成(填“是”或者“否”)____。
【答案】搅拌(适当升温或增大浸取剂的浓度) ③ 2Co(OH)3 +6HCl=2CoCl2 +Cl2↑+6H2O 蒸发浓缩、冷却结晶 根据NiR2+2H+![]() Ni2+ +2HR可知,加入H2SO4使c(H+)增大,平衡向右移动 Cd(NH3)42+ +CO32-
Ni2+ +2HR可知,加入H2SO4使c(H+)增大,平衡向右移动 Cd(NH3)42+ +CO32-![]() CdCO3↓ + 4NH3↑ NH3、有机萃取剂 否
CdCO3↓ + 4NH3↑ NH3、有机萃取剂 否
【解析】
已知已预处理的电池粉末,经过NH3和(NH4)2CO3水溶液的浸取后,得到的滤液①中含有Ni(NH3)62+、Cd(NH3)42+、Co(NH3)62+等物质,在滤液①中通入空气进行催化氧化,得到Co(OH)3沉淀和滤液②,从而将Co元素分离出来,Co(OH)3与盐酸发生氧化还原反应得到CoCl2溶液,再经过蒸发浓缩、冷却结晶、过滤、洗涤得到CoCl26H2O晶体;在滤液②中加入有机萃取剂,发生反应Ni(NH3)62++ 2HR![]() NiR2+2NH4++4NH3,从而将Cd元素与Ni元素分离,水相中含有Cd(NH3)42+,将水相加热并通入热水蒸气会生成CdCO3沉淀;在有机相中加入硫酸进行反萃取,发生反应NiR2+2H+
NiR2+2NH4++4NH3,从而将Cd元素与Ni元素分离,水相中含有Cd(NH3)42+,将水相加热并通入热水蒸气会生成CdCO3沉淀;在有机相中加入硫酸进行反萃取,发生反应NiR2+2H+![]() Ni2+ +2HR,得到NiSO4溶液,再经过蒸发浓缩、冷却结晶、过滤、洗涤得到NiSO46H2O晶体,据此分析解答。
Ni2+ +2HR,得到NiSO4溶液,再经过蒸发浓缩、冷却结晶、过滤、洗涤得到NiSO46H2O晶体,据此分析解答。
(1)搅拌、适当升温或增大浸取剂的浓度,均可加快浸取速率;
(2)通过表2中,浸取过程中氨总量与各离子浸取率的关系数据可知,当n(NH3)+n(NH4+)=4.8mol时,对Ni、Cd、Co浸取率都比较高,因此可采用的最佳实验条件编号为③;
(3)Co(OH)3与盐酸反应生成CoCl2溶液,由此可知Co元素表现了氧化性,则HCl表现还原性,产生的气体单质应为Cl2,根据得失电子守恒,元素守恒可配平该反应的化学方程式为2Co(OH)3+6HCl=2CoCl2+Cl2↑+6H2O;
(4)CoCl2溶液经过蒸发浓缩、冷却结晶、过滤、洗涤得到CoCl26H2O晶体;
(5)根据以上分析可知,在有机相中加入硫酸进行反萃取,发生反应NiR2+2H+![]() Ni2+ +2HR,得到NiSO4溶液,从平衡移动原理的角度解释,即根据NiR2+2H+
Ni2+ +2HR,得到NiSO4溶液,从平衡移动原理的角度解释,即根据NiR2+2H+![]() Ni2+ +2HR可知,加入H2SO4使c(H+)增大,平衡向右移动,从而得到NiSO4溶液;
Ni2+ +2HR可知,加入H2SO4使c(H+)增大,平衡向右移动,从而得到NiSO4溶液;
(6)水相中含有Cd(NH3)42+、CO32-,将水相加热并通入热水蒸气会生成CdCO3沉淀,并产生使红色石蕊试纸变蓝的气体,则该气体为NH3,则该反应的离子方程式为Cd(NH3)42++CO32-![]() CdCO3↓ +4NH3↑;
CdCO3↓ +4NH3↑;
(7)由以上分析可知,上述工艺流程中可能循环使用的物质为NH3、有机萃取剂;
(8)当Cd2+恰好沉淀完全时,溶液中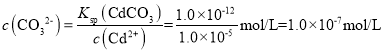 ,此时溶液中,Q(NiCO3)=c(Ni2+)c(CO32-)=0.1×1.0×10-7=1.0×10-8<Ksp(NiCO3),故没有NiCO3沉淀生成。
,此时溶液中,Q(NiCO3)=c(Ni2+)c(CO32-)=0.1×1.0×10-7=1.0×10-8<Ksp(NiCO3),故没有NiCO3沉淀生成。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学反应与能量变化的说法正确的是
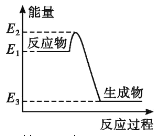
A. 如图所示的化学反应中,反应物的键能之和大于生成物的键能之和
B. 相同条件下,氢气和氧气反应生成液态水比生成等量的气态水放出的热量少
C. 金刚石在一定条件下转化成石墨能量变化如图所示,热反应方程式可为:C(s金刚石) =C(s,石墨) H=-(E2—E3)kJ·mol—1
D. 同温同压下,H2(g)+C12(g)==2HCl(g)能量变化如图所示,在光照和点燃条件下的△H相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属原子在二维空间里的放置有下图所示的两种方式,下列说法中正确的是( )
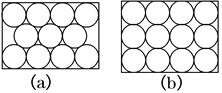
A.图(a)为非密置层,配位数为6
B.图(b)为密置层,配位数为4
C.图(a)在三维空间里堆积可得六方密堆积和面心立方密堆积
D.图(b)在三维空间里堆积仅得简单立方堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“太阳水”电池装置如图所示,该电池由三个电极组成,其中 a 为TiO2电极,b 为Pt 电极,c 为 WO3 电极,电解质溶液为 pH=3 的 Li2SO4-H2SO4 溶液。锂离子交换膜将电池分为 A、B 两个区,A 区与大气相通,B 区为封闭体系并有 N2 保护。下列关于该电池的说法错误的是
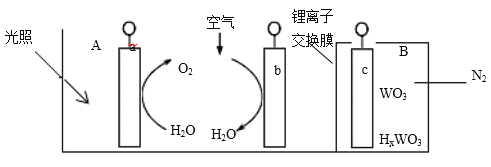
A.若用导线连接a、c,则 a 为负极,该电极附近 pH 减小
B.若用导线连接 a、c,则 c 电极的电极反应式为HxWO3-xe-=WO3+ xH+
C.若用导线连接 b、c,b 电极的电极反应式为 O2+4H++4e-=2H2O
D.利用该装置,可实现太阳能向电能转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯(C3H6)是石油化工行业重要的有机原料之一,主要用于生产聚丙烯、二氯乙烯、异丙烯等产品。
(1)丙烷脱氢制备丙烯。由图可得C3H8(g)![]() C3H6(g)+H2(g) ΔH=___kJ/mol。
C3H6(g)+H2(g) ΔH=___kJ/mol。

①为了同时提高反应速率和反应物的平衡转化率,可采取的措施是___。
②目前在丙烷脱氢制丙烯时常加入适量的O2,让其同时发生下列反应:
2C3H8(g)+O2(g)![]() 2C3H6(g)+2H2O(g) ΔH=-235kJ/mol,通入O2的目的是___。
2C3H6(g)+2H2O(g) ΔH=-235kJ/mol,通入O2的目的是___。
(2)以C4H8和C2H4为原料发生烯烃歧化反应C4H8+C2H4![]() 2C3H6(g) ΔH>0。
2C3H6(g) ΔH>0。
①某温度下,上述反应中,正反应速率为v正=k正c(C4H8)c(C2H4)、逆反应速率为v逆=k逆c2(C3H6),其中k正、k逆为速率常数,该反应使用WO3/SiO2为催化剂,下列说法中正确的是___。
A.催化剂参与了歧化反应,但不改变反应历程
B.催化剂使k正和k逆增大相同的倍数
C.催化剂降低了烯烃歧化反应的活化能,增大了活化分子百分数
D.速率常数的大小与反应历程无关系
②已知t1min时达到平衡状态,测得此时容器中n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=bmol且平衡时C3H6的体积分数为25%。再往容器内通入等物质的量的C4H8和C2H4,在新平衡中C3H6的体积分数___25%。(填“>”、“<”、“=”)
(3)工业上可用丙烯加成法制备1,2—二氯丙烷(CH2ClCHClCH3),主要副产物为3—氯乙烯(CH2=CHCH2Cl),反应原理为
Ⅰ.CH2=CHCH3(g)+Cl2(g)![]() CH2ClCHClCH3(g)
CH2ClCHClCH3(g)
Ⅱ.CH2=CHCH3(g)+Cl2(g)![]() CH2=CHCH2Cl(g)+HCl(g)
CH2=CHCH2Cl(g)+HCl(g)
一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I、Ⅱ,容器内气体的压强随时间的变化如下表所示。
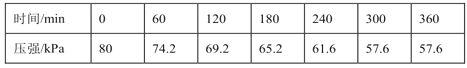
①用单位时间内气体分压的变化来表示反应速率,即v=![]() ,则前120min内平均反应速率v(CH2ClCHClCH3)=___kPamin-1。
,则前120min内平均反应速率v(CH2ClCHClCH3)=___kPamin-1。
②该温度下,若平衡时HCl的体积分数为12.5%,反应Ⅰ的平衡常数Kp=__kPa-1。(Kp为以分压表示的平衡常数,保留小数点后2位。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是探究某气体化学性质的实验装置,图中B为活塞。如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C中红色布条颜色褪去。则D瓶中盛有的溶液是( )
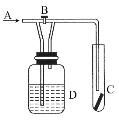
A.浓H2SO4B.饱和NaCl溶液
C.NaOH溶液D.NaBr溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂—磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式:___。与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有___(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为 ___。
(2)PO43- 的空间构型是____。
(3)与NH3互为等电子体的分子、离子有___、 __(各举一例)。
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为___。

(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4] 2-,则1molCN-中含有的π键的数目为____。
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如右图所示。则该化合物的化学式为____。
(7)铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,列式计算晶体铜的密度____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用热的氢氧化钠溶液洗去试管内壁沾有的硫单质,发生反应6NaOH+3S![]() 2Na2S+Na2SO3+3H2O。关于该反应的说法不正确的是( )
2Na2S+Na2SO3+3H2O。关于该反应的说法不正确的是( )
A. 硫既是氧化剂又是还原剂 B. 硫化钠是还原产物
C. 硫既表现氧化性又表现还原性 D. 消耗3 mol 硫,转移电子6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铜工厂预处理过的污泥渣(主要成分为 CuO 和 Cu)为原料制备 CuSO45H2O 晶体的流程如下 :
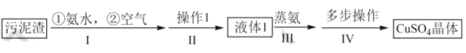
已知:①CuO在氨水作用下可以生成 Cu(NH3)4(OH)2
②CuSO45 H2O 加热到 4 5℃时开始失水。
请回答:
(1)步骤 l 中,空气的主要作用是____。
(2)下列关于步骤II说法不正确的是____。
A.操作 1 可选择倾析法过滤, 玻璃棒的作用是: 先搅拌, 再引流
B.操作 1 应趁热过滤, 要防止液体 1 中的溶质因冷却而析出
C.操作 1 为抽滤,在加入需抽滤的物质时,用玻璃棒引流液体, 玻璃棒底端需紧贴在滤纸上
D.抽滤时,布氏漏斗的底部斜口面需正对抽滤瓶的抽气口处, 是为了提高抽滤的速率
(3)液体 1 通过步骤 III 与步骤IV可得到CuSO45 H2O 晶体 。
①蒸氨过程的生成物均是由两种元素组成的化合物, 则除氨外其余产物的化学式为_____。
②步骤IV中包含多步操作, 将下列步骤按正确的步骤排序(必要时步骤可重复选)。_____→得到固体物质→ ____ →将液体放于蒸发皿中加热→ ____→_____→_____→_____ →得到晶体
a.过滤 b.用玻璃棒不断搅拌溶液 c.用足量稀硫酸溶解固体 d.停止加热 e.至溶液表面析出晶膜
(4)步骤1中分别选用氨水、氨水-碳酸铵混合溶液氨浸时, 铜元素回收率随温度变化如图所示。
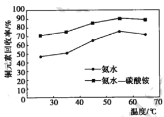
①浸取液为氨水时,反应温度控制为 55℃,温度过高铜元素回收率降低的原因是_______。
②浸取液为氨水一碳酸铵混合溶液时,铜元素回收率受温度影响较小的原因可能是______。
(5)为了提高 CuSO4晶体的产率, 实验室还采用以下方法: 将CuSO4 溶液转移至蒸馏烧瓶中, 加入适量冰醋酸, 通过下图所示的装置获取晶体。
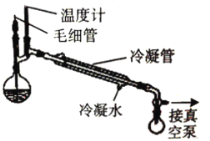
①加入适量乙酸的目的是:_____。
②图中接真空泵的作用是:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com