
(14分)据图回答下列问题:
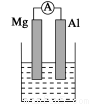
Ⅰ、(1)若烧杯中溶液为稀硫酸,则观察到的现象是 ___________________
负极反应式为:______________________________。
(2)若烧杯中溶液为氢氧化钠溶液,则负极为________(填Mg或Al),总反应化学方程式为____________________________________。
Ⅱ、由Al、Cu、浓硝酸组成原电池,其正极的电极反应式为
Ⅲ、中国科学院长春应用化学研究所在甲醇燃料电池技 术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。
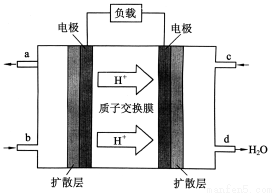
①该电池工作时,b口通入的物质为_______,
c口通入的物质为______。
②该电池负极的电极反应式为:_______
③工作一段时间后,当12.8 g甲醇完全反应生成CO2时,______________NA个电子转移。
(14分)I(1)Mg逐渐溶解 Al片上有气泡冒出 指针偏转(2分)
Mg-2e-=Mg2+(1分)
(2)Al (1分) 2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2分)
II.NO3-+e-+H+=NO2↑+H2O(2分)
III. ①CH3OH(1分) O2或空气(1分)
②CH3OH-6e-+H2O=CO2+6H+(2分) ③2.4(2分)
【解析】
试题分析:I、(1)若烧杯中溶液为稀硫酸,则Mg与稀硫酸反应,所以Mg作负极,Al作正极,实验现象是Mg逐渐溶解、Al片上有气泡冒出、指针偏转;负极的反应式为Mg-2e-=Mg2+;
(2)若烧杯中溶液为氢氧化钠溶液,则Al与氢氧化钠反应,所以Al作负极,总反应即是Al与NaOH的反应,化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
II、Al与浓硝酸发生钝化,所以Cu与浓硝酸反应,则Cu作负极,正极是NO3-发生还原反应生成二氧化氮,电极反应式为NO3-+e-+H+=NO2↑+H2O;
III、①根据图中氢离子的移动方向判断右侧是正极,左侧是负极,负极通入甲醇,所以b口通入的物质是CH3OH,正极通入的是空气或氧气,所以c口通入的是空气或氧气;
②负极发生氧化反应,根据图中所给信息,甲醇发生氧化反应后生成二氧化碳和氢离子,电极反应式为CH3OH-6e-+H2O=CO2+6H+;
③12.8 g甲醇完全转化为二氧化碳时,转移电子的物质的量是12.8g/32g/mol×6=2.4mol。
考点:考查原电池反应原理,正负极的判断、电极反应式的书写,氧化还原反应的计算


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014重庆一中高二下学期期末考试化学试卷(解析版) 题型:填空题
(15分)下表是元素周期表的一部分,请参照①~⑥在表中的位置,用化学用语回答下列问题:
| I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
2 |
|
| ① | ② | ③ | ④ |
|
|
3 |
|
|
|
| ⑤ |
| ⑥ |
|
(1) ⑥有两种同位素,其中一种原子核内有18个中子,其原子符号为_______;
(2)②与④可以形成一种温室气体,其电子式为_______;
(3) ③和⑤的氢化物沸点 __________(填分子式)高,原因是______________;
(4)②和⑥按原子个数比为1:4形成的化合物为_______分子(填极性或非极性),含有_______键(填极性或非极性)
(5) ②形成的单质可以是不同类型的晶体,它们可能是____________(填字母)
A原子晶体 B分子晶体 C金属晶体 D离子晶体 E.混合型晶体
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:选择题
下列实验步骤与实验事实的相应结论解释正确的是
选项 | 实验步骤与实验事实 | 结论解释 |
A | Mg(OH)2、Al(OH)3混合物中加入NaOH溶液,Al(OH)3溶解而Mg(OH)2没有溶解 | Mg(OH)2Ksp比Al(OH)3的小 |
B | ZnS能溶解在稀盐酸中,CuS不能溶解在稀盐酸中 | CuS的Ksp比ZnS的小 |
C | 在溶有NH3的BaCl2溶液中通入CO2,有白色沉淀生成 | NH3在反应中作催化剂 |
D | 单质硅不溶于浓硫酸和浓硝酸 | 硅被强氧化性酸钝化 |
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省高三仿真测试理科综合化学试卷(解析版) 题型:填空题
氮、磷、锌、铁等是与生命活动密不可分的元素。请回答下列问题:
(1) NH3和PH3都是极性分子,其中极性较大的是______,理由是 。
(2) 20mL0.1 mol·L-1次磷酸(H3PO2)溶液与20 mL 0.1 mol·L-1 NaOH溶液恰好中和生成正盐,则H3PO2的结构式是 。
(3) 下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式
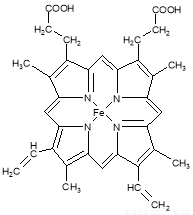

血红素中N原子的杂化方式为 ,在右图的方框内用“→”标出Fe2+的配位键。
(4) N2与CO互为等电子体。下表是两者的键能
数据(单位:kJ·mol-1):
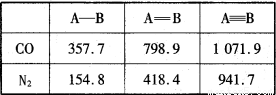
结合数据说明CO比N2活泼的原因:_____。
(5) Zn2+基态时的电子排布式是______,ZnO和ZnS的晶体结构相似,其中熔点较高的是______,理由是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省高三仿真测试理科综合化学试卷(解析版) 题型:选择题
分析下表中各项的排布规律,有机物X是按此规律排布的第19项,下列有关X的结构和性质说法中一定错误的是
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
A.是戊酸,同分异构体有4种
B.是酯,在稀硫酸条件下水解的两种产物的相对分子质量不可能相等
C.可以发生银镜反应
D.可以与溴水发生加成反应
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省五校第二学期期末联考高一化学试卷(解析版) 题型:选择题
丁烷有两种常见裂解方式,每种方式均分别生成一种烷烃和一种烯烃。若丁烷裂解率为90%,两种裂解方式生成的烯烃的质量相等,则裂解后所得混合气体中,相对分子质量最小的气体的体积分数约为
A. 19% B. 25% C. 36% D. 40%
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省五校第二学期期末联考高一化学试卷(解析版) 题型:选择题
下图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图。
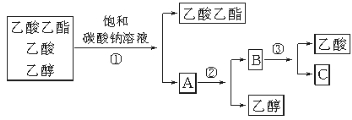
在上述实验过程中,所涉及的三次分离操作分别是
A.①蒸馏、②过滤、③分液 B.①分液、②蒸馏、③蒸馏
C.①蒸馏、②分液、③分液 D.①分液、②蒸馏、③结晶、过滤
查看答案和解析>>
科目:高中化学 来源:2013-2014福建龙岩市毕业联合考试理综化学试卷(解析版) 题型:填空题
(15分)A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
元素 | A | B | C | D | E |
相关 信息 | 最高正价与最低负价代数和为2 | 与元素C可形成离子个数比为2:1和1:1的化合物 | 单质质软,通常保存在煤油中 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属,人体缺少该元素易患贫血症 |
回答以下问题(化学用语中的元素用相应的元素符号表示)。
(1)C在元素周期表中的位置是 。
(2)B、D元素对应的相对分子质量最小的氢化物受热分解所需温度B D(填“>”、“<”或“=”)。
(3)检验E3+离子的方法是 。
(4)鉴别D的两种氧化物的试剂是 (仅限一种);常温常压下DO2与一氧化碳反应生成 1.6g D单质与另一种氧化物,并放出14.86kJ的热量,写出此反应的热化学方程式 。
(5)0.1mol·L-1C2D溶液中各种离子浓度从大到小的顺序是 。
(6)AO2、O2和熔融NaAO3可制作燃料电池,其原理如图所示。该电池在使用过程电极Ⅰ生成氧化物Y,写出电极Ⅱ的反应式 。

查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县高二下学期期末考试化学试卷(解析版) 题型:选择题
六氟化硫分子为正八面体构型(分子结构如图所示),难溶于水,有良好的绝缘性、阻燃,在电器工业方面具有广泛用途。下列推测正确的是( )
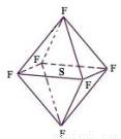
A.SF6中各原子均达到8电子稳定结构 B.SF6二氯取代物有3种
C.SF6分子是含有极性键的非极性分子 D.SF6是原子晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com