
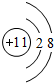 ��
�� ��
������ A��B��C��DΪ������Ԫ�أ��˵������������A��ԭ�ӽṹ���Ԫ�أ���AΪ�⣬���ڵ�һ���ڣ�A��B��C����Ԫ�ص�ԭ�Ӻ�����Ӳ���֮��Ϊ5����B��Cֻ�ܴ��ڵڶ����ڣ�BԪ��ԭ��������ϵĵ�����������Ӳ�����2��������������Ϊ4����BΪ̼Ԫ�أ�A��C֮����γ�A2C��A2C2���ֻ������CΪ��Ԫ�أ�D��ͬ��������Ԫ����ԭ�Ӱ뾶�����IA�壬ԭ����������������DΪNa��
��� �⣺A��B��C��DΪ������Ԫ�أ��˵������������A��ԭ�ӽṹ���Ԫ�أ���AΪ�⣬���ڵ�һ���ڣ�A��B��C����Ԫ�ص�ԭ�Ӻ�����Ӳ���֮��Ϊ5����B��Cֻ�ܴ��ڵڶ����ڣ�BԪ��ԭ��������ϵĵ�����������Ӳ�����2��������������Ϊ4����BΪ̼Ԫ�أ�A��C֮����γ�A2C��A2C2���ֻ������CΪ��Ԫ�أ�D��ͬ��������Ԫ����ԭ�Ӱ뾶�����IA�壬ԭ����������������DΪNa��
��1��CΪ��Ԫ�أ���Ԫ�����ڱ��е�λ���ǵڶ����ڵ�VIA�壬DΪNa�����ӽṹʾ��ͼΪ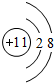 ��
��
�ʴ�Ϊ���ڶ����ڵ�VIA�壻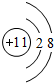 ��
��
��2��BC2ΪCO2��������̼Ϊ���ۻ����̼����֮���γ����Թ��ۼ���������̼���γɹ���Ϊ��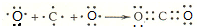 ��
��
�ʴ�Ϊ��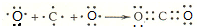 ��
��
��3����ת����ˮ�����ʵ���Ϊamol����
C��s��+H2O��g��?CO��g��+H2��g��
��ʼ��mol����1 0 0
ת����mol����a a a
ƽ�⣨mol����1-a a a
2min��������ѹǿ������20%����1mol����1+20%��=1+a����a=0.2����2min��H2O�ķ�Ӧ����Ϊ$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/��L•min����
A�����ӹ��嵥�ʵ���������Ӱ�컯ѧ��Ӧ���ʣ���A����
B�����º���ʱ�ڸ�������ͨ��Ar�����ı䷴Ӧ�и������ʵ�Ũ�ȣ��ʻ�ѧ��Ӧ���ʲ��䣬��B����
C���淴Ӧ�����У���������������������������䣬��������ܶ������ܶȲ��ٱ仯�����жϸ÷�Ӧ�ﵽ��ƽ�⣬��C��ȷ��
D��2minʱ��H2O��ת����Ϊ$\frac{0.2mol}{1mol}$��100=20%����D����
E��1molˮ��Ӧ�õ�1molCO��1mol�������������ƽ����Է�������Ϊ15���ʻ��������ƽ����Է���������С��ƽ����Է�����������˵������ƽ�⣬��E��ȷ��
�ʴ�Ϊ��0.05mol/��L•min����CE��
��4��COȼ�����ɶ�����̼��������̼��Ӧ����̼�������������������Ӧ����ȼ�ϵ�صĸ�����ӦΪ��CO+4OH--2e-=CO32-+2H2O��
�ʴ�Ϊ��CO+4OH--2e-=CO32-+2H2O��
��5��D��C�γɻ�ѧʽΪNa2O2�Ļ��������ǿ����ʣ�Na2O2�л�ѧ�������Ӽ������ۼ�����0.2mol Na2O2Ͷ�뵽����0.1mol FeCl2��ˮ��Һ�г�ַ�Ӧ���������Ʒ�Ӧ�õ�0.4molNaOH��0.1mol������0.1mol FeCl2��Ӧ����0.2molNaOH�õ�0.1mol Fe��OH��2��ʣ��0.2molNaOH��0.1mol Fe��OH��2ת��Ϊ0.1mol Fe��OH��3��������Ϊ$\frac{0.1mol}{4}$=0.025mol��������0.075mol��������Ӧ���ܵĻ�ѧ����ʽΪ��8Na2O2+4FeCl2+H2O�T4Fe��OH��3��+8NaOH+8NaCl+3O2����
�ʴ�Ϊ��ǿ�����Ӽ������ۼ���8Na2O2+4FeCl2+H2O�T4Fe��OH��3��+8NaOH+8NaCl+3O2����
���� ������Ԫ���ƶ�Ϊ���壬����ṹ����λ�ù�ϵӦ�á�����ʽ�뷽��ʽ�ȳ��û�ѧ�����ѧƽ���йؼ��㡢ԭ��ء���ѧ����ȣ�ˮ�Ի���֪ʶ���ۺϿ��飬��Ҫѧ���߱���ʵ�Ļ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
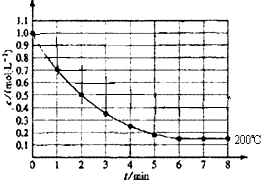 ��һ�ܱ������з���1molX��g��������Ӧ��X��g��?4Y��g��+Z��g������ͼ��ʾ�� 200��ʱ��X��Ũ����ʱ��仯�����ߣ�
��һ�ܱ������з���1molX��g��������Ӧ��X��g��?4Y��g��+Z��g������ͼ��ʾ�� 200��ʱ��X��Ũ����ʱ��仯�����ߣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʵ����ʢ��̼������Һ���Լ�ƿ�����ò����� | |
| B�� | ��ĭ�������̼��������Һ����������Һ��ʹ��ʱֻ�轫����ϾͿɲ�������������̼����ĭ | |
| C�� | ���Ȼ����Һ��ȥ���� | |
| D�� | ����̼�����������ȡ����������̼ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 32 S | B�� | 4 He | C�� | 14 N | D�� | 32 Si |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com