
| A、加入适量的氯化铵晶体后,两溶液的pH均碱小 |
| B、温度下降10°C,两溶液的pH均不变 |
| C、分别加水稀释10倍,两溶液的pH仍相等 |
| D、用同浓度的盐酸中和,消耗盐酸的体积相同 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、H7N9型禽流感是一种新型禽流感,流感病毒通常检测方法是基于核酸检测的原理.核酸一种是蛋白质 |
| B、侯德榜发明了侯氏制碱法、维勒用氮气和氢气合成了氨气、阿伦尼乌斯创立了电离学说、扫描隧道显微镜的发明和STM技术应用等等,这些都对化学学科的应用和发展作出了重要的贡献 |
| C、使用可再生资源、注重原子的经济性、推广利用二氧化碳与环氧丙烷生成的生物降解材料等都是绿色化学的内容 |
| D、化学帮助人类创造和合成了大量材料,如高纯硅制作太阳能电池、聚氯乙烯塑料用来食品包装、人造刚玉Al2O3用作耐高温材料等等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1MPa | 2MPa | 3MPa | |
| 500℃ | 45.3% | ||
| 700℃ | a | 66.7% | |
| 900℃ | 73.6% |
| A、该反应的△H<0 |
| B、45.3%<a<66.7% |
| C、该反应的平衡常数K(900℃)<K(700℃) |
| D、700℃、2 MPa时R的转化率为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、干冰可以用于人工降雨 |
| B、推广使用可降解塑料,有助于减少“白色污染” |
| C、将熟石灰和硝酸铵混合施用,肥效更高 |
| D、环境保护应从源头消除污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨气通过无水氯化钙粉末 |
| B、氢气通过灼热的氧化铜粉末 |
| C、铝与氧化铁发生铝热反应 |
| D、将锌粒投入到硝酸铜溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性强弱:HClO>H2SO4>H2CO3 |
| B、热稳定性:HF>HCl>HBr |
| C、已知硒(Se)与硫同主族,其最高价氧化物对应的水化物分子式为:H2SeO3 |
| D、原子半径大小:Na>P>N |
查看答案和解析>>
科目:高中化学 来源: 题型:
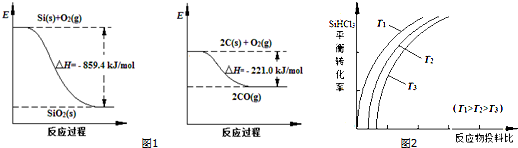
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
| 一定条件 |
| n(SiHCl3) |
| n(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸铜溶液中加过量的氨水:Cu2++2NH3?H2O═Cu(OH)2↓+2NH4+ |
| B、用食醋检验牙膏中碳酸钙的存在:CaCO3+2H+═Ca2++CO2↑+H2O |
| C、用碘化钾淀粉溶液检验亚硝酸钠中NO2-的存在:NO2-+2I-+2H+═NO↑+I2+H2O |
| D、向硫酸铝铵[NH4Al(SO4)2]溶液中滴加足量Ba(OH)2溶液NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3?H2O+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com