
分析 (1)将Fe2+以Fe(OH)2形式完全沉淀,pH≥9.6,此时Cu2+以Cu(OH)2的形式完全沉淀,若将Fe2+氧化成Fe3+,Fe3+以Fe(OH)3形式完全沉淀,pH在3~4,此时Cu2+没有形成沉淀;
(2)NaClO为强碱弱酸盐,水解呈碱性,则加入NaClO,溶液的pH一定增大,另外NaClO可以酸反应生成HClO而导致溶液pH增大,氧化亚铁离子时会有氢离子参加,也导致溶液pH增大;
(3)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,注意不能引入新杂质.
解答 解:(1)A.因直接加碱,调整溶液pH≥9.6,Fe2+以Fe(OH)2形式完全沉淀,此时的pH≥9.6,同时Cu2+以Cu(OH)2的形式完全沉淀,不但除去了Fe2+,也除去了Cu2+,不符合除杂的原则,故A错误;
B.因铜粉的还原性比铁弱,不能将Fe2+还原出来,故B错误;
C.将Fe2+氧化成Fe3+,Fe3+以Fe(OH)3形式完全沉淀,pH在3~4,此时Cu2+形成没有沉淀,过滤除去Fe(OH)3沉淀,既除去了杂质,也没有除去原物质,故C正确;
D.通入硫化氢,使Fe2+、Cu2+分别形成FeS沉淀,CuS沉淀,不但除去了Fe2+,也除去了Cu2+,不符合除杂的原则,故D错误;
故答案为:C;
(2)NaClO为强碱弱酸盐,水解呈碱性,则加入NaClO,溶液的pH一定增大,另外NaClO可以酸反应生成HClO而导致溶液pH增大,氧化亚铁离子时会有氢离子参加,也导致溶液pH增大,
故答案为:B;
(3)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,注意不能引入新杂质,则则可用CuO 或Cu(OH)2或CuCO3,A、B均引入新杂质,C不能除杂,
故答案为:D.
点评 本题考查分离提纯实验的设计,为高频考点,把握物质的性质、氧化还原反应、盐类水解原理等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
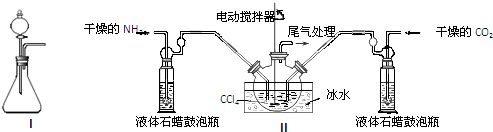
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置 | 溶液不变浑浊,证明固体中不含碳酸铵. |
| 步骤3:向试管中继续加入少量澄清石灰水. | 溶液变浑浊,证明固体中含有碳酸氢铵. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
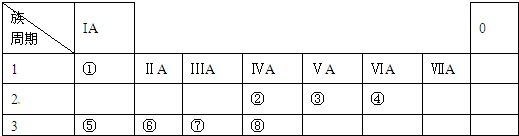
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4?Ba2++SO42- | B. | HF═H++F- | ||
| C. | HI?H++I- | D. | NaHCO3═Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目增加,导电性增强 | |
| B. | 醋酸的电离程度增大,[H+]减小 | |
| C. | 电离平衡向右移动,电离常数Ka减少 | |
| D. | 稀释后溶液中由水电离出的[H+]=1×10-11 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO3->BrO3->Cl2>Fe3+>I2 | B. | BrO3->Cl 2>ClO3->I2>Fe3+ | ||
| C. | BrO3->ClO3->Cl2>Fe3+>I2 | D. | BrO3->ClO3->Fe3+>Cl2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
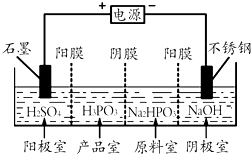 亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3.
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3-.亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200ml 0.1mol/LFeCl3溶液 | B. | 100ml 0.1mol/L MgCl2溶液 | ||
| C. | 200ml 0.1mol/L NaCl溶液 | D. | 100ml 0.4mol/L BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com