
在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末测得容器中有1.6 mol SO2,请计算:
(1)2 min末SO3的浓度;
(2)2 min内SO2的平均反应速率。
科目:高中化学 来源:2015-2016学年湖南省高二下期中化学试卷(解析版) 题型:实验题
某化学兴趣小组,拟探究和比较SO2和C12的漂白性,设计如下图所示的实验装置二套。请你参与探究并回答下列问题。

(1)向第一套装置中通入一段时间的SO2,观察到试管中的品红溶液 (填“能”或“不能” )褪色,然后再加热试管,溶液 (填“恢复”或“不恢复”)红色;
(2)向第二套装置中通入一段时间的C12,观察到试管中的品红溶液也褪色,然后再加热试管,溶液 (填“恢复”或“不恢复”)红色;
(3)由以上两个实验可以说明SO2和C12的漂白原理 (填“相同”或“不相同”);
(4) C12通入品红溶液中,生成的具有漂白性的物质是 (填“HC1”或“HClO”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下期中化学试卷(解析版) 题型:选择题
关于具有相同的电子层结构的短周期元素aA2+、bB+、cC3+、dD-,下列说法中正确的是
A.原子半径C>A>B>D B.价电子数D>C>A>B
C.离子半径C3+>D->B+>A2+ D.单质的还原性A>B>C>D
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省赣州市十三县(市)高二下期中化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
A.标准状况下,22.4L H2S全部溶于水所得溶液中HS-和S2-离子数之和为NA
B.含4mol HCl的浓盐酸与足量二氧化锰反应转移的电子总数为2NA
C.11g T2O含有的电子数为5NA
D.常温下,0.2L 0.5mol/L NH4NO3溶液的氮原子数小于0.2NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省赣州市十三县(市)高二下期中化学试卷(解析版) 题型:选择题
过量的下列溶液与水杨酸(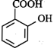 )反应能得到化学式为C7H5O3Na的是( )
)反应能得到化学式为C7H5O3Na的是( )
A.NaHCO3溶液 B.Na2CO3溶液 C.NaOH溶液 D.NaCl溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省邵阳市高一下期中化学试卷(解析版) 题型:选择题
将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应
2A(g)+B(g) 2C(g) 若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
2C(g) 若经 2 s(秒)后测得 C 的浓度为 0.6 mol·L-1 ,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·(L·s)-1
② 用物质 B 表示的反应的平均速率为 0.6 mol·(L·s)-1
③ 2 s 时物质 A 的转化率为70%
④ 2 s 时物质 B 的浓度为 0.7 mol·L-1
其中正确的是( )
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省邵阳市高一下期中化学试卷(解析版) 题型:选择题
为了说明影响化学反应进行快慢的因素,甲、乙、丙、丁四位同学分别设计了如下A~D四个实验,你认为结论不正确的是( )
A.大小相同、形状相同的镁条和铝条与相同浓度的盐酸反应时,两者速率一样大
B.在相同条件下,等质量的大理石块和大理石粉与相同浓度的盐酸反应时,大理石粉反应快
C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解
D.两支试管中分别加入相同质量的氯酸钾,向其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省娄底市双峰县高一下期中化学试卷(解析版) 题型:填空题
W、X、Y、Z、M、G六种元素分属三个短周期,且原子序数依次增大。W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性。请回答下列问题:
(1)Y在元素周期表中的位置为_________,上述元素的最高价氧化物对应的水化物酸性最强的是_____(写化学式),W、Y、Z、M形成的简单离子的半径大小顺序是___________________(用化学符号表示),G的离子结构示意图:_______________。
(2) Y与M的氢化物中,热稳定性更好的是____________(填化学式),原因是____________________________________________________________。
(3)Z2Y2的电子式为__________,ZW与水反应放出气体的化学方程式为_______________________________________________________________________。
(4)X2W4可作为新型燃料电池的燃料,在氧气中燃烧生成氮气和水,请利用X2W4、氧气与KOH溶液组成碱性燃料电池,写出该电池负极的电极反应式________________________,指出电解质溶液中OH-离子向________极移动。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期中化学试卷(解析版) 题型:填空题
五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构.A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,C和E形成的化合物CE在水中呈中性。回答下列问题:
(1)五种元素中,原子半径最大的是________,非金属性最强的是________(填元素符号);
(2)由A和B、D、E所形成的共价型化合物中,热稳定性最差的是________(用化学式表示);
(3)A和E形成的化合物与A和B形成的化合物反应,产物的化学式为__________,其中存在的化学键类型为____________;
(4)单质E与水反应的离子方程式为________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com