
| A. | X与Y形成化合物时,X显负价,Y显正价 | |
| B. | 电负性X>Y | |
| C. | 最高价含氧酸的酸性:X对应的酸性弱于Y对应的酸性 | |
| D. | 失去第一个电子消耗能量:X>Y |
分析 X、Y元素同周期,且第一电离能Y小于X,X原子序数可能大于Y,也可能小于Y,
A.X与Y形成化合物时,X可能显负价也可能显正价;
B.电负性X可能大于Y也可能小于Y;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;
D.元素的第一电离能越大,其失去第一个电子消耗的能量越大.
解答 解:X、Y元素同周期,且第一电离能Y小于X,X原子序数可能大于Y,也可能小于Y,
A.X与Y形成化合物时,X可能显负价也可能显正价,如第一电离能N>O,但NO中N为正化合价,故A错误;
B.电负性X可能大于Y也可能小于Y,如第一电离能N>O,但电负性N<O,故B错误;
C.元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,第一电离能Cl>S,但高氯酸的酸性大于硫酸,故C错误;
D.元素的第一电离能越大,其失去第一个电子消耗的能量越大,所以失去第一个电子消耗能量:X>Y,故D正确;
故选D.
点评 本题考查元素周期律,为高频考点,明确第一电离能与元素非金属性强弱关系是解本题关键,注意同一周期第一电离能反常现象,为易错题.


科目:高中化学 来源: 题型:解答题
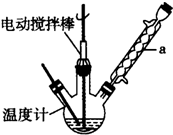 甲苯(
甲苯(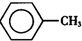 )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(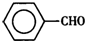 )、苯甲酸(
)、苯甲酸(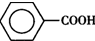 )等
)等| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 相对密度(ρ水=1g/cm3) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8660 | 不溶 | 互溶 |
| 苯甲醛 | 无色液体 | -26 | 179 | 1.0440 | 微溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.1 | 249 | 1.2659 | 微溶 | 易溶 |
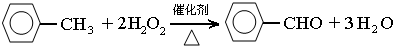 ,此反应的原子利用率理论上可达66.25%.
,此反应的原子利用率理论上可达66.25%.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
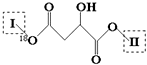 (其中I、II为未知部分的结构):为推测X的分子结构,现进行如图所示的转化.
(其中I、II为未知部分的结构):为推测X的分子结构,现进行如图所示的转化.
 .
. .
.
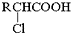 ;RCH2Br$→_{②H_{2}O/H+}^{①NaCN}$RCH2COOH
;RCH2Br$→_{②H_{2}O/H+}^{①NaCN}$RCH2COOH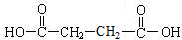 .
.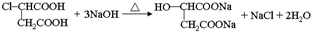 .
.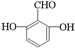 、
、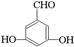 、
、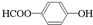 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、O2、NO | B. | N2、O2、CO2 | C. | N2、NO | D. | N2、O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com