
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=________,ΔH________0(填“<”、“>”或“=”);
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol 的A和0.80 mol 的B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1,则6 s时c(A)=________ mol·L-1,C的物质的量为________mol;若反应经一 段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol 氩气,平衡时A的转化率为________;
段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol 氩气,平衡时A的转化率为________;
(3)判断该反应是否达到平衡的依据为________(填正确选项前的字母);
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)1 200 ℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
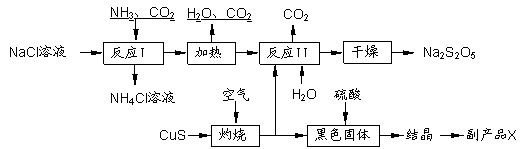 |
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)反应I的化学方程式为: 。
(3)“灼烧”时 发生反应的化学方程式: 。
发生反应的化学方程式: 。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(5)副产品X的化学式是 。
(6)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约
为 。检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水
④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲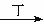 乙
乙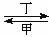 丙。下列有关物质的推断不正确的是
丙。下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2 B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是氯气 D.若甲为NaOH溶液,则丁可能是CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的方程式错误的是
A.测得0.1 mol·L-1氨水的pH为11:NH3·H2O NH4+ +OH-
NH4+ +OH-
B.将Na块投入水中,产生气体:2Na+2H2O=2NaOH+H2↑
C.用CuCl2溶液做导电实验,灯泡发光:CuCl2 Cu2++2Cl-
Cu2++2Cl-
D.将1 mol·L-1FeCl3溶液滴入沸水中,得到透明红褐色液体:
FeCl3+3H2O Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
4种短周期元素相对位置如右表。M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素。回答下列问题:
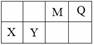
(1)X的原子结构示意图为 。
(2)0.1 molQ的10电子氢化物与CuO反应生成Cu2O、H2O和Q单质时,生成Cu2O的物质的量是 。
(3)Y的氧化物与NaOH溶液反应的化学方程式是 。
(4)HR是含M元素的一元酸。常温下,0.1 mol·L-1 HR 溶液中,c(H+) = 1.3×10-3 mol·L-1。则HR  H++R-的电离平衡常数Ka= (保留一位小数)。
H++R-的电离平衡常数Ka= (保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g) 2CO2(g)+S(l) ΔH<0
2CO2(g)+S(l) ΔH<0
若反应在恒容的密闭容器中进行,下列有关说法正确的是( )
A.平衡前,随着反应的进行,容器内压强始终不变
B.平衡时,其他条件不变,分离出硫,正反应速率加快
C.平衡时,其他条件不变,升高温度可提高SO2的转化率
D.其他条件不变,使用不同催化剂,该反应的平衡常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,10 mL 0.40 mol/L H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:
v(H2O2)≈3.3×10-2mol·L-1·min-1
B.0~6 min的平均反应速率:
v(H2O2)<3.3×10-2mol·L-1·min-1
C.反应至6 min时,c(H2O2)=0.30 mol/L
D.反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
298 K时,某容积固定为1 L的密闭容器中发生如下可逆反应:A(g)2B(g) ΔH=a  kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
kJ·mol-1。其中B的物质的量浓度随时间变化如图所示。
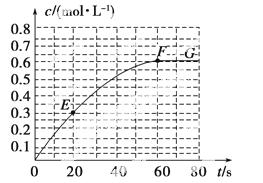
试回答下列问题:
(1)已知298 K时60 s达到平衡,则前60 s内A的平均反应速率为________mol·L-1·s-1。
(2)该反应的平衡常数表达式为________。
(3)若298 K时B的平衡浓度为A的3倍,323 K时( 其他条件不变),B的平衡浓度为A的2倍。且达到平衡所需时间为298 K时的
其他条件不变),B的平衡浓度为A的2倍。且达到平衡所需时间为298 K时的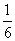 。该反应中ΔH________0(填“>”或“<”)。
。该反应中ΔH________0(填“>”或“<”)。
(4)若反应在298 K进行,在1 L密闭容器中加入1 mol B、0.2 mol Ne,达到平衡时B的转化率为________(填序号)。
A.等于60% B.等于40%
C.小于40% D.介于40%~60%之间
(5)已知曲线上任意两点之间连线的斜率表示该时间段内B的平均反应速率(例如直线EF的斜率表示20 s~60 s内B的平均反应速率),则曲线上任意一点的切线斜率的意义是______________________________________________ __________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向一容积不变的密闭容器中充入一定量A和B,发生反应:xA(g)+2B(s)  yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0。在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
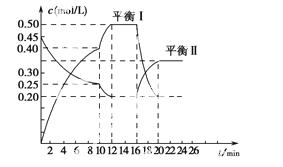
(1)用A的浓度变化表示该反应0~10 min内的平均反应速率v(A)=________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是________;第16 min引起曲线变化的反应条件可能是________。
①减压 ②增大A的浓度 ③增大C的量 ④升温
⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ的平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com