
| A. | Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO | |
| B. | BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeO | |
| C. | Be(OH)2只能溶于盐酸,不能溶于NaOH溶液 | |
| D. | BeCl2水溶液的导电性强,故BeCl2是离子化合物 |
分析 在周期表中Be和Al位于对角线位置,性质相似,由反应BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓可知,BeCl2与Na2BeO2发生互促水解生成Be(OH)2,类似于氯化铝与偏铝酸钠的反应.
A.Na2BeO2为强碱弱酸盐,水解呈碱性,将其蒸干,灼烧后可得残留物Na2BeO2;
B.BeCl2为强酸弱碱盐,水解呈酸性,将其蒸干,灼烧后可得残留物BeO;
C.Be(OH)2性质类似于氢氧化铝,具有两性;
D.根据化合物在熔融状态下能否导电来判断其是否是离子化合物,共价化合物在水溶液中也可以导电.
解答 解:A.Na2BeO2溶液水解呈碱性,溶液的pH>7,将其蒸干,水解得到的氢氧化钠又与Be(OH)2反应得到Na2BeO2,灼烧后可得残留物Na2BeO2,故A错误;
B.BeCl2为强酸弱碱盐,水解呈酸性,溶液的pH<7,将其蒸干,HCl挥发,水解彻底,得到Be(OH)2,灼烧后可得残留物BeO,故B正确;
C.Be(OH)2性质类似于氢氧化铝,具有两性,则既能溶于盐酸,又能溶于NaOH溶液,故C错误;
D.在熔融状态下能导电的化合物是否是离子化合物,共价化合物在水溶液中也可以导电,BeCl2水溶液导电性强,不能说明BeCl2是离子化合物,故D错误.
故选B.
点评 本题考查元素周期律及盐类水解的应用,侧重于学生自学能力、知识迁移能力的考查,题目难度中等,注意结合铝的化合物性质解答.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 将Al条投入NaOH溶液中:Al+OH-+H2O═[Al(OH)4]-+H2↑ | |
| B. | 向氯化铵的稀溶液中加入少量NaOH NH4++OH-═NH3↑+H2O | |
| C. | 浓盐酸与铁屑反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 向浓硝酸中加入铜片Cu+4H++2N03-═Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
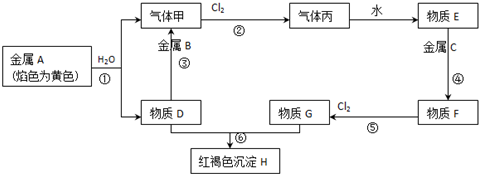
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
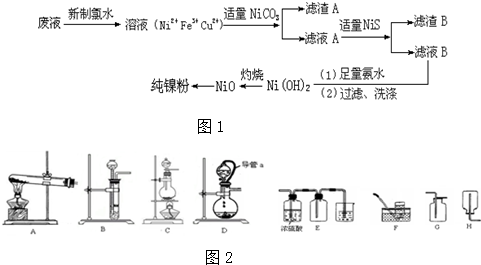
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | 0 |
| 1 | ||||||||
| 2 | A | |||||||
| 3 | B | C | D | E |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
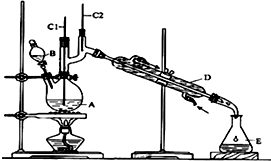 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.发生的反应如下:| 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水应保存在棕色瓶中 | B. | 少量金属钠保存在煤油中 | ||
| C. | 漂白粉可露置于空气中保存 | D. | 液溴采用液封法保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ; B的结构简式CH3CH2CHO;B的物质的量0.06mol;
; B的结构简式CH3CH2CHO;B的物质的量0.06mol;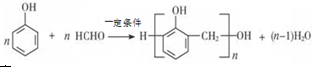 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com