
| A. |  | B. | 26M3+ | C. | 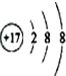 | D. | 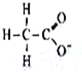 |
分析 根据影响因素来进行判断,影响因素有温度、酸、碱、盐等,加酸、加碱抑制水的电离;能水解的盐促进水的电离;据此即可解答.
解答 解:A、氯化氢在水中电离,HCl=H++Cl-,水的电离方程式为H2O?H++OH-,使水的电离平衡向逆反应方向移动,抑制水的电离,故A错误;
B、质子数为26的元素为铁元素,故26M3+为铁离子,是弱碱阳离子,在溶液中水结合水电离出的氢氧根而水解,故对水的电离有促进作用,故B错误;
C、此结构示意图代表的是氯离子,是强酸根,不能水解,对水的电离无影响,故C错误;
D、此结构式为CH3COO-,是弱酸根,在溶液中水解,故对水的电离有促进作用,故D错误.
故选C.
点评 本题考查了水的电离的影响因素,明确微粒的性质对水的电离的影响是解答的关键,题目较简单.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 活化能的大小对化学反应的能量变化不产生影响 | |
| B. | 化学键的断裂和形成是化学反应中发生能量变化的主要原因 | |
| C. | HCl(aq)和NaOH(aq)反应的中和热为57.3 kJ/mol,则CH3COOH(aq)和NaOH(aq)完全反应生成1 mol H2O(l)时,放出的热量为57.3 kJ | |
| D. | CO(g)的燃烧热是283.0 kJ/mol,则反应2CO2(g)=2CO(g)+O2(g)的反应热△H=+566.0kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液蒸干 | |
| D. | 稀释浓硫酸时,应将浓硫酸沿器壁缓缓注入水中,并用玻璃棒不断搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原溶液中一定含有SCN- | B. | 原溶液中一定含有NO3- | ||
| C. | 原溶液可能呈酸性 | D. | Fe2+被Br2氧化成Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
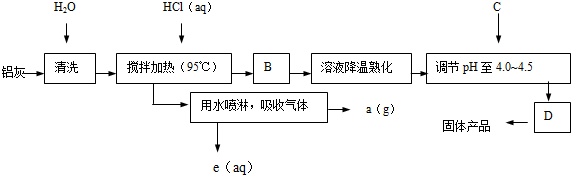
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备1一溴丁烷的反应和实验装置如图:
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备1一溴丁烷的反应和实验装置如图:| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | |
| 正丁醇 | -89.53 | 117.25 | 0.81 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.28 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
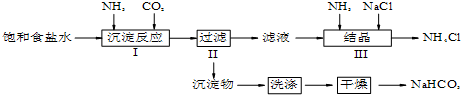
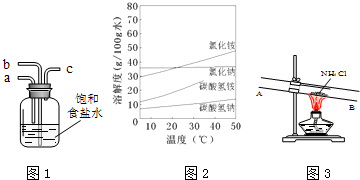
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com