
已知涤纶树脂的结构简式为:

(1)写出合成涤纶树脂所需要单体的结构简式:________和________。
(2)写出以对二甲苯、乙烯、食盐、氧化剂和水为原料,合成涤纶树脂的化学方程式。
__________________________________________________
__________________________________________________
科目:高中化学 来源: 题型:
取A、B两份物质的量浓度相等的NaOH溶液,体积均为50mL,分别向其中通入一定量的CO2后,再分别稀释到100 mL,在稀释后的溶液中分别滴加0.1mol/L的盐酸,产生的CO2体积(标准状况)与所加盐酸的体积关系如图所示,下列说法正确的是
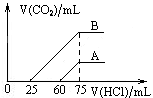 A.原NaOH溶液的物质的量浓度0.075mol·L-1
A.原NaOH溶液的物质的量浓度0.075mol·L-1
B.A曲线表明原溶液通入CO2后,所得溶质为NaOH和Na2CO3,此时用酚酞作指示剂,溶液颜色变化时消耗盐酸的体积为75mL
C.B曲线表明原溶液通入CO2后,所得溶质为Na2CO3和NaHCO3且物质的量之比为1:1
D.B曲线表明原溶液通入CO2后,所得溶质与盐酸反应产生气体的最大体积为33.6 mL(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
| 选项 | 实验操作 | 离子方程式 |
| A | 在铁和铝混合物中加入足量氢氧化钠溶液,过滤除去铝 | 2Al+2OH-+H2O===2AlO |
| B | 用盐酸洗涤试管中的氢氧化铜 | OH-+H+===H2O |
| C | 在氯化铝溶液中滴偏铝酸钾溶液 | Al3++3AlO |
| D | 用石灰乳与碳酸钠溶液反应制少量氢氧化钠 | Ca2++CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
光刻胶是制大规模集成电路、印刷电路板和激光制板技术中的关键材料。某一肉桂酸型光刻胶的主要成分A经光照固化转变为B。


(1)请指出A中含有的官能团:________(填两种)。
(2)A经光照固化转变为B,发生了________反应(填反应类型)。
(3)写出A与NaOH溶液反应的化学方程式:____________
___________________________________________________。
(4)写出B在酸性条件下水解得到的芳香族化合物的分子式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
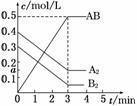 在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)
在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)  2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是( )
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是( )
A.图中a点的值为0.15
B.该反应的平衡常数K=0.03
C.温度升高,平衡常数K值减小
D.平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
2N2O5(g)  4NO2(g)+O2(g) ΔH>0
4NO2(g)+O2(g) ΔH>0
T1温度下的部分实验数据为:
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)/mol/ L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A.500 s内N2O5分解速率为2.96×10-3 mol/(L·s)
B.T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C.其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
查看答案和解析>>
科目:高中化学 来源: 题型:
进入2013年以来,我国中东部地区多次遭遇大范围、长时间的雾霾天气。车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。
(1)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
|
T/℃ n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.10 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
①结合上表数据,写出NO与活性炭反应的化学方程式 。
②上述反应T1℃时的平衡常数K1= 。
③根据上述信息判断,温度T1和T2的关系是(填序号) 。
a.T1>T2 b.T1<T2 c.无法比较
 (2)车辆排放的氮氧化物和碳氧化物在催化剂作用下可发生反应:
(2)车辆排放的氮氧化物和碳氧化物在催化剂作用下可发生反应:
2CO+2NO N2+2CO2 在一体积为1L的密闭容积中,加入0.40mol的CO和0.40mol的NO ,反应中N2的物质的量浓度的变化情况如图所示,回答下列问题。

①计算从反应开始到平衡时,平均反应速率v(N2)= 。
②在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时N2的浓度约为
0.25 mol/L)。请在上图中画出第5分钟末到此平衡时N2浓度的变化曲线。
(3)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,在一定条件下,用CH4还原NOX可以消除氮氧化物的污染。
 例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
2NO2(g) N2O4(g) △H=-56.9 kJ/mol
写出CH4还原N2O4(g)生成N2和H2O(g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放目的。通过人工光合作用,以CO2和H2O为原
料可以制备HCOOH和O2,计算标况下每回收1.0m3 CO2转移的电子数为 个。
③常温下,0.1mol/L的HCOONa溶液的pH为10,则HCOOH的电离常数Ka = 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com