
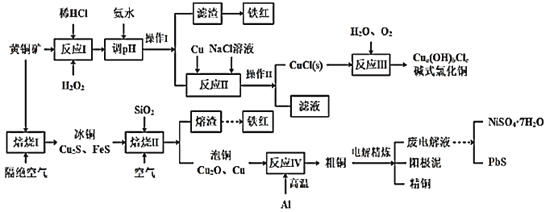
【题目】我国黄铜矿的储量比较丰富,主要产地集中在长江中下游地区、川滇地区、山西南部、甘肃的河西走廊以及西藏高原等地。黄铜矿是一种铜铁硫化物矿物,外观黄铜色,主要成分是CuFeS2,还含有少量的SiO2和Ni、Pb、Ag、Au等元素。为实现黄铜矿的综合利用,设计了如下的工艺流程。
已知:①a、b、c均为整数;②CuCl+2Cl-![]() CuCl32-。
CuCl32-。
(1)CuFeS2中S的化合价为___。铁红的主要成分是___(填化学式)。
(2)实验测得“反应I”中有SO42-生成,该反应离子方程式为___,选H2O2溶液优于HNO3的原因是___。
(3)“反应II”中NaCl浓度过大,碱式氯化铜产率较低,其原因是____。
(4)写出“焙烧I”发生反应的化学方程式___。
(5)废电解液中含有少量的Pb2+,从废电解液中除去Pb2+的方法是往其中通人H2S至饱和,使Pb2+转化为硫化物沉淀,若废电解液的pH=4,为保证不生成NiS沉淀,Ni2+浓度应控制在___以下。(已知:饱和H2S溶液中c(H2S)为0.1mol/L,H2S的电离常数Ka1=1.0×10-7,Ka2=2.0×10-15,Ksp(NiS)=1.4×10-16)
【答案】-2 Fe2O3 2CuFeS2+17H2O2+2H+=2Cu2++2Fe3++4SO42-+18H2O 不引入杂质离子,无污染 氯离子浓度大,CuCl+2Cl-![]() CuCl32-平衡正向移动,导致CuCl的浓度减小,生成的碱式氯化铜的量减少,产率 较低 2CuFeS2
CuCl32-平衡正向移动,导致CuCl的浓度减小,生成的碱式氯化铜的量减少,产率 较低 2CuFeS2![]() Cu2S+2FeS+S 0.07mol/L
Cu2S+2FeS+S 0.07mol/L
【解析】
本题中存在两个流程,第一个流程目的是以黄铜矿为原料生产碱式氯化铜,黄铜矿(主要含CuFeS2及少量Fe2O3、SiO2),加入稀盐酸酸浸,SiO2不溶于稀盐酸,溶液中浸出Cu2+,Fe2+,Fe3+等离子,加入H2O2溶液,酸性条件下H2O2将Fe2+氧化为Fe3+,加入氨水调节溶液pH,使Fe3+形成Fe(OH)3沉淀除去Fe3+,进行操作Ⅰ过滤,得到SiO2、Fe(OH)3滤渣,溶液中则存在Cu2+为主,还存在SO42-,加入Cu和NaCl溶液,反应生成CuCl沉淀,经过操作Ⅱ过滤得到CuCl(s)和滤液,加入H2O和O2发生反应Ⅲ,得到碱式氯化铜;
第二个流程中先将黄铜矿隔绝空气焙烧,得到Cu2S和FeS等,加入石英砂通入空气焙烧,生成Cu2O、Cu,熔渣为Fe2O3等,Cu2O、Cu与铝在高温下发生铝热反应得到粗铜,电解可得到精铜。
(1)根据呈电中性CuFeS2,Cu为+2价,Fe为+2价,所以S为-2价,铁红的主要成分是Fe2O3;
(2)实验测得反应I中有SO42-生成,由S2-转化得到,H2O2作为氧化剂还会将CuFeS2中的二价铁氧化成三价,结合电子守恒和元素守恒可得方程式为:2CuFeS2+17H2O2+2H+=2Cu2++2Fe3++4SO42-+18H2O;
H2O2作为氧化剂其还原产物无污染,且不引入新的杂质,而HNO3的还原产物污染环境且引入杂质;
(3)根据题目提供信息CuCl+2Cl-![]() CuCl32-,当氯离子浓度过大时平衡正向移动,导致CuCl的浓度减小,生成的碱式氯化铜的量减少;
CuCl32-,当氯离子浓度过大时平衡正向移动,导致CuCl的浓度减小,生成的碱式氯化铜的量减少;
(4)根据流程可知产物中有Cu2S和FeS,通的化合价降低,则必有元素的化合价升高,反应物只有CuFeS2,铁元素化合价没变,可知S的化合价升高,又因为隔绝空气焙烧,所以氧化产物应为S单质,故方程式为:2CuFeS2![]() Cu2S+2FeS+S;
Cu2S+2FeS+S;
(5)饱和H2S溶液中c(H2S)为0.1mol/L,溶液pH=4,则溶液中c(H+)=10-4mol/L,根据Ka1=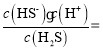 1.0×10-7,可解的c(HS-)约为10-4mol/L,根据Ka2=
1.0×10-7,可解的c(HS-)约为10-4mol/L,根据Ka2=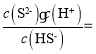 2.0×10-15,解得溶液中c(S2-)约为2.0×10-15mol/L,Ksp(NiS)=1.4×10-16=c(Ni2+)·c(S2-),所以为保证不生成NiS沉淀,Ni2+浓度应小于
2.0×10-15,解得溶液中c(S2-)约为2.0×10-15mol/L,Ksp(NiS)=1.4×10-16=c(Ni2+)·c(S2-),所以为保证不生成NiS沉淀,Ni2+浓度应小于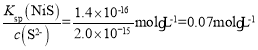 。
。


科目:高中化学 来源: 题型:
【题目】S-诱抗素制剂能保持鲜花盛开,S-诱抗素的分子结构如图,下列关于该物质说法正确的是

A.S-诱抗素制剂分子中所有碳原子不可能处于同一平面上
B.1 mol S-诱抗素制剂最多能 4 mol Br2 发生加成反应
C.在 Cu 或 Ag 做催化剂、加热条件下能被 O2 氧化为醛
D.该化合物不能发生聚合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2CO3是一种二元弱酸,常温下H2CO3水溶液中碳元素的存在形态的物质的量分数与溶液的pH的关系如图所示,据此分析,下列说法不正确的是( )
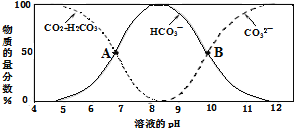
A.pH=8时,溶液中含碳元素的微粒主要是HCO3—
B.A点,溶液中H2CO3和HCO3-浓度相同
C.当c(HCO3-)=c(CO32-)时,c(H+)<c(OH-)
D.pH=8.4的水溶液中加入NaOH溶液时,发生反应的离子方程式可为:HCO3-+OH-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
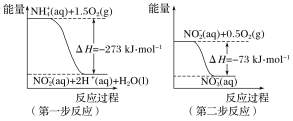
①第一步反应是________(填“放热”或“吸热”)反应,判断依据是________________。
②1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是___________________________。
(2)已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+0.5O2(g) ΔH=-226kJ·mol-1②
则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为________________。
(3)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72kJ·mol-1,蒸发1molBr2(l)需要吸收的能量为30kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11,草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
①0.1mol·L-1Na2CO3溶液的pH____0.1mol·L-1Na2C2O4溶液的pH。(填“大于”“小于”或“等于”)
②碳酸钠溶液显碱性的原因是_____________________________ 。(用主要的离子方程式表示)
③若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种粒子浓度大小的顺序正确的是______(填字母)。
a.c(H+)>c(HC2O4-)>c(HCO3-)>c(CO32-)
b.c(HCO3-)>c(HC2O4-)>c(C2O42-)>c(CO32-)
c.c(H+)>c(HC2O4-)>c(C2O42-)>c(CO32-)
d.c(H2CO3)>c(HCO3-)>c(HC2O4-)>c(CO32-)
(2)用氨水除去SO2。
已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol·L-1,溶液中的c(OH-)=________mol·L-1。将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol·L-1时,溶液中的c(SO32-)/c(HSO3-)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与实验现象对应的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 向浓度为0.1mol/LNaCl、KI混合液中逐滴加入AgNO3溶液 | 出现黄色沉淀 | 溶解性:AgCl>AgI |
B | 溴乙烷与NaOH的乙醇溶液共热,将溢出气体通入酸性高锰酸钾溶液中 | 溶液紫色褪去 | 证明有乙烯生成 |
C | 向X的溶液中滴入浓NaOH溶液,将干燥红色石蕊试纸置于管口 | 无明显现象 | X溶液中有NH4+ |
D | 将SO2气体通入Ba(NO3)2溶液 | 产生白色沉淀 | 沉淀为BaSO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ ![]() O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ ![]() O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图中各装置的叙述正确的是( )

A.装置①可制备少量氧气
B.装置②可用于实验室制取和收集乙酸乙酯
C.装置③的实验可推断硫、碳、硅三种元素的非金属强弱
D.装置④能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:
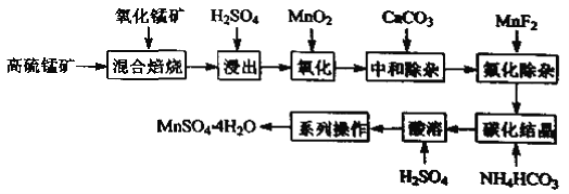
已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):
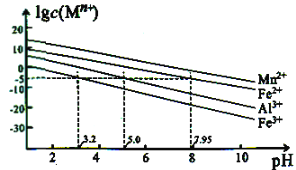
③此实验条件下Mn2+开始沉淀的pH为7.54;当离子浓度≤105mol·L1时,可认为离子沉淀完全。
请回答:
(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为____。
(2)“氧化”时,发生反应的离子方程式为____。若省略“氧化”步骤,造成的后果是____。
(3)“中和除杂”时,生成沉淀的主要成分为____(填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于____。(已知:Ksp(MgF2)=6.4×1010;Ksp(CaF2)=3.6×1012)
(5)“碳化结晶”时,发生反应的离子方程式为_____。
(6)用惰性电极电解MnSO4溶液可制备MnO2,电解过程中阳极的电极反应式为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com