


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氟利昂化学性质稳定、有毒 |
| B、氟利昂会产生温室效应 |
| C、氟利昂会破坏臭氧层 |
| D、氟利昂会形成酸雨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
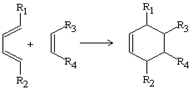

查看答案和解析>>
科目:高中化学 来源: 题型:
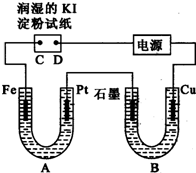 电解装置如图所示.图中B装置盛1L 3mol?L-1 K2SO4溶液,A装置中盛1L 3mol?L-1 AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答:
电解装置如图所示.图中B装置盛1L 3mol?L-1 K2SO4溶液,A装置中盛1L 3mol?L-1 AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答:| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g?cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
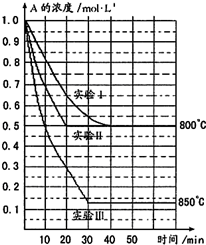 在一恒容密闭容器中发生某化学反应:2A(g)?B(g)+C(g)(A气体有颜色),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol?L-1)随时间(min)的变化如图所示:试回答下列问题:
在一恒容密闭容器中发生某化学反应:2A(g)?B(g)+C(g)(A气体有颜色),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol?L-1)随时间(min)的变化如图所示:试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com