
【题目】若NA表示阿伏加德罗常数的值,下列叙述正确的是:
①标准状况下,11.2升乙醇完全燃烧产生的CO2的 分子数为0.5NA
②标准状况下,a L的氧气和氮气的混合物含有的分子数为![]()
③60gSiO2晶体中含有2NA个Si-O键
④某条件下,将1mol N2和3mol H2在密闭容器中充分反应,生成NH3分子数为2NA
⑤常温下7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.1NA
A.①④B.②③C.③⑤D.②⑤
科目:高中化学 来源: 题型:
【题目】某兴趣小组在实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,并探究溴乙烷的性质。反应原理和实验装置如下(加热装置未画出):
H2SO4(浓)+NaBr![]() NaHSO4+HBr↑ CH3CH2OH+HBr
NaHSO4+HBr↑ CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O

有关数据见下表:
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红色液体 |
密度/(g·cm3) | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
Ⅰ.溴乙烷的制备:
(1)若图甲中A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,其化学方程式为__________;F连接导管通入稀NaOH溶液中,其目的主要是_________;导管E的末端须低于D的水面,其目的是__________。
(2)为了除去粗产品中的氧化性杂质,宜选择下列_________ (填序号)溶液来洗涤所得粗产品。
A.氢氧化钠 B.碘化钾 C.碳酸氢钠 D.亚硫酸钠
(3)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g。从乙醇的角度考虑,本实验所得溴乙烷的产率是___________。
Ⅱ.溴乙烷性质的探究
用如图乙实验装置(铁架台、酒精灯略)验证溴乙烷的性质:在试管中加入10mL6mol·L1NaOH溶液和2mL溴乙烷,振荡、静置,液体分层,水浴加热。
(4)观察到___________,表明溴乙烷与NaOH溶液已完全反应。
(5)为证明溴乙烷在NaOH乙醇溶液中反应的气体产物为乙烯,将生成的气体通入如图丙装置。a试管中的水的作用是 ___________,若无a试管,b试管中的试剂应为___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化锰是制造锌锰干电池的基本材料,工业上以软锰矿、菱锰矿为原料来制备。某软锰矿主要成分为MnO2,还含有Si(16.27%),Fe(5.86%),Al(3.42%),Zn(2.68%)和Cu(0.86%)等元素的氧化物,其处理流程图如下:
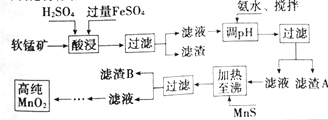
化合物 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 |
KSP近似值 | 10-34 | 10-16 | 10-38 |
(1)灼烧软锰矿样品时,铜的焰色为___(填字母)。
A.黄色 B.绿色 C.紫色 D.红色
(2)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要离子反应方程式为___。
(3)“氨水、搅拌”,其中“搅拌”不仅能加快反应速率,还能___。滤渣S的成分是Fe(OH)3、Al(OH)3,加入氨水需调节pH至少达到___,恰好能使Fe3+、Al3+沉淀完全(当c≤10-5mol·L-1时,认为该离子沉淀完全)。
(4)滤渣B的成分是___。
(5)工业上采用间接氧化还原滴定法测定MnO2纯度,其操作过程如下:准确称量0.9200g该样品,与足量酸性KI溶液充分反应后,配制成100mL溶液。取其中10.00mL,恰好与25.00mL0.0800 mol·L-1 Na2S2O3溶液反应(I2+2S2O32-=2I-+S4O62-)。计算该样品纯度为___%(精确到0.1%)。
(6)从废旧碱性锌锰电池中可以回收利用的物质有___(写两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等。已知FeCO3、MnCO3难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,主要物质转化关系如下:

(1)设备1中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。滤渣1的主要成分是 (填化学式)。
(2)设备1中发生氧化还原反应的离子方程式是 。
(3)设备2中加足量双氧水的作用是 。设计实验方案检验滤液2中是否存在Fe2+: 。
(4)设备4中加入过量氢氧化钠溶液,沉淀部分溶解,。用化学平衡移动原理解释原因: 。
(5)设备3中用阴离子膜法提取金属锰的电解装置图如下:

① 电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的 极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 。
② 该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中成药连花清瘟胶囊在对抗 H1N1 病毒中发挥重大作用,其有效成分绿原酸的结构简式如图,下列有关说法错误的是( )

A.绿原酸属于芳香族化合物
B.分子式 C16H18O9
C.1mol 绿原酸与 Na 反应放出 H2 的体积 134.4L
D.1mol 绿原酸可以与 7molH2 发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列反应的方程式(必要时注明反应条件)
(1)实验室制备氯气的化学反应方程式 _______________。
(2)乙醇催化氧化反应(铜作催化剂)_______________。
(3)苯与浓硝酸反应____________________。
(4)CH3CH=CH2发生加聚反应___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数的值。下列有关说法正确的是
A.3 g 乙烷中所含共价键数目为 0.6 NA
B.1 mol CH3+中含电子数为 10 NA
C.4.6 g 甲酸和二甲醚(CH3OCH3)的混合物中所含分子数为 0.1 NA
D.标准状况下,11.2 L 苯完全燃烧后生成的 CO2 分子数为 3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是( )
A. 沸点A2D<A2X
B. CA3分子是非极性分子
C. C形成的单质中σ键与π键个数之比为1∶2
D. B、C、D形成的气态氢化物互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出用键线式表示的有机物的分子式![]() 分子式:______。
分子式:______。
(2)![]() 分子中最多有 ___________个原子共直线;最多有___________个原子共平面。
分子中最多有 ___________个原子共直线;最多有___________个原子共平面。
(3)烯烃A是2-丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,则A的结构简式为___________; A与溴的四氯化碳溶液反应的化学方程式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com