
(14分)(Ⅰ)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇。
已知某些化学键的键能数据如下表:
化学键 | C—C | C—H | H—H | C—O | C≡O | H—O |
键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
请回答下列问题:
(1)已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为
;
(2)某化学研究性学习小组模拟工业合成甲醇的反应,在容积固定为2L的密闭容器内充入1 molCO和 2 molH2,加入合适催化剂(体积可以忽略不计)后在250°C开始反应,并用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.6 | 10.8 | 9.5 | 8.7 | 8.4 | 8.4 |
则从反应开始到20min时,以CO表示的平均反应速率= ,该温度下平衡常数K= ,若升高温度则K值 (填“增大”、“减小”或“不变”);
(3)下列描述中能说明上述反应已达平衡的是 ;
A.2 v (H2)正 = v (CH3OH)逆
B.容器内气体的平均摩尔质量保持不变
C.容器中气体的压强保持不变
D.单位时间内生成 n molCO 的同时生成 2n molH2
(Ⅱ)回答下列问题:
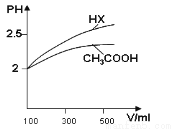
(1)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,
则Ka(HX) ______ Ka(CH3COOH)(填>、<或=)
(2)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中C(CH3COO?)-c(Na+)=_________mol·L-1(填精确值)。
Ⅰ(1)CO(g)+2H2(g)  CH3OH(g) △H= -116 KJ/mol
CH3OH(g) △H= -116 KJ/mol
(2)0.0125mol/(L·min); 4 (mol/L)-2; 减小。
(3)B C
Ⅱ(1)> ; (2)9.9×10-7 。
【解析】
试题分析:Ⅰ(1)CO(g)+2H2(g)  CH3OH(g) △H= -116 KJ/mol
CH3OH(g) △H= -116 KJ/mol
(2) CO(g) + 2H2(g)  CH3OH(g)
CH3OH(g)
起始: 1 mol 2 mol 0 mol
变化: x mol 2x mol x mol
平衡:(1-x)mol 2(1-x)mol x mol
依题意有以下关系式:(依据物质的量之比等于压强之比)

 x=0.5
x=0.5
所以从反应开始到20min时,以CO表示的平均反应速率:v(CO)=
 0.0125mol/(L·min); 平衡常数:k=
0.0125mol/(L·min); 平衡常数:k=

由第一小题可知该反应为放热反应,当升高温度时,平衡向着热的方向,也就是逆向移动,因此平衡常数的数值减小。
(3)A.错误,正确的应该为: v (H2)正 = 2 v (CH3OH)逆 ; B.因为正向是气体物质的量减小的方向,而反应前后气体总的质量是不变的,只要是正向移动,混合气体的摩尔质量就会增大,反应就会减小,因此,容器内气体的平均摩尔质量保持不变时,一定是化学反应达到平衡状态之时,正确;C.同理,容器中气体的压强保持不变时,也是达到平衡状态之时;D.单位时间内生成 n molCO 的同时生成 2n molH2,这个关系式是永远存在的。因此选:B C
Ⅱ(1)从图中可以看出,加入相同量的水,HX的PH值变化大一点,也即HX这种酸酸性强一点,Ka(HX)>Ka(CH3COOH);
(2)依据电荷守恒,有以下关系式:c(CH3COO?)+c(OH-)=c(Na+)+c(H+)
所以有:c(CH3COO?)-c(Na+)=c(H+)-c(OH-)=10-6-10-8=9.9×10-7
考点:考查化学平衡,水溶液中的电离平衡。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014甘肃兰州一中高二下学期期末考试化学试卷(解析版) 题型:选择题
已知:乙醇可被强氧化剂氧化为乙酸。BrCH2CH=CHCH2Br可经三步反应制取HOOCCHClCH2COOH.,其中第二步的反应类型是 ( )
A.水解反应 B.加成反应 C.氧化反应 D.消去反应
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃兰州一中高一下学期期末考试化学试卷(解析版) 题型:选择题
某有机物的结构简式如右图.该物质不应有的化学性质是
①可燃烧②可跟溴加成③可使酸性KMnO4溶液褪色④可跟NaHCO3溶液反应⑤可跟NaOH溶液反应⑥可在碱性条件下水解⑦可与新制备的Cu(OH)2悬浊液煮沸生成红色沉淀
A. ①② B. ③④ C. ④⑤ D. ⑥⑦
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南长沙县一中、浏阳一中、宁乡一中高三5月化学试卷(解析版) 题型:实验题
(14分 每空2分)化工原料红矾钠(重铬酸钠:Na2Cr2O7·2H2O)主要是以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3、SiO2等杂质)为主要原料生产,其主要工艺流程如下:
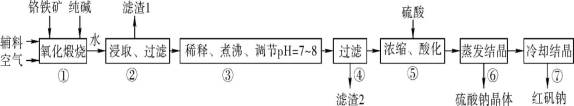
步骤①中主要反应的化学方程式如下:
4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1) ①中反应是在回转窑中进行的,反应时需不断搅拌,其作用是 。
(2) 杂质Al2O3在①中转化的化学反应方程式为 。
(3) 用化学平衡移动原理说明③中煮沸的作用是 (用离子方程式结合文字说明),若调节pH过低产生的影响是 。
(4) ⑤中酸化是使CrO42-转化为Cr2O72-写出该反应的离子方程式: 。

(5) 工业上还可用电解法制备重铬酸钠,其装置示意图如上。
阴极的电极反应式为 ;
阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南长沙县一中、浏阳一中、宁乡一中高三5月化学试卷(解析版) 题型:选择题
下列与生活相关的叙述错误的是
A.酸性臭氧水(AOW)可用于消灭HlNl病毒,因为臭氧具有强氧化性
B.水的处理常用到漂白粉和明矾,二者的作用原理相同
C.二氧化硫、氮氧化物以及可吸入颗粒物这三项是雾霾主要组成
D.地沟油的主要成分是油脂,其组成与汽油、煤油不相同
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省长沙市高三高考二模理综化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.在NaClO溶液中通入过量SO2气体:ClO-+H2O+SO2=HClO+HSO3-
B.用稀氢碘酸溶液除去铁制品表面的铁锈:Fe2O3+6H+ =2Fe3+ +3H2O
C.NaHCO3与少量的Ca(OH)2溶液反应:Ca2++2OH-+2HCO3- = CaCO3↓+2H2O+CO32-
D.10mL0.5mol/L的明矾溶液与20mL0.5mol/LBa(OH)2溶液混合反应:3Ba2+ + 6OH- +2Al3+ +3SO42- = 3BaSO4↓+2Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高二下学期期末考试化学试卷(解析版) 题型:实验题
学习小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料: 该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
Ⅰ.摩擦剂中氢氧化铝的定性检验: 取适量牙膏样品,加水搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是______________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是________________。
Ⅱ.牙膏样品中碳酸钙的定量测定:利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。

依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有______
(4)C中反应生成BaCO3的化学方程式是__________________________
(5)下列各项措施中,不能提高测定准确度的是_________(填标号)。
A.在加入盐酸之前,应排净装置内的CO2气体;
B.滴加盐酸不宜过快;
C.在A—B之间增添盛有浓硫酸的洗气装置
D.在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g 。则样品中碳酸钙的质量分数为_________。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是______________。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高二下学期期末考试化学试卷(解析版) 题型:选择题
在无色透明的酸性溶液中,能较大量共存的离子组是( )
A. MnO4-、K+、SO42-、Na+ B.Na+、SiO32-、K+、NO3-
C.NH4+、NO3-、Al3+、Cl- D.K+、SO42-、HCO3-、Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com