
【题目】工业上采用软锰矿(主要成分为MnO2)来制取硫酸锰,工艺流程如下:
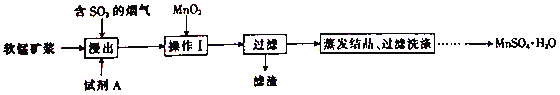
已知:浸出液中的金属离子主要是Mn2+,还含有少量的Fe2+。回答下列问题:
(1)实验室进行过滤操作时用到的玻璃仪器有玻璃棒、烧杯和______。
(2)浸出后,锰主要以Mn2+的形式存在,写出MnO2与SO2反应的离子方程式:____________。
(3)浸出过程的副反应之一是部分SO2被氧化为硫酸,致使浸出液的pH下降,这将不利于软锰矿浆继续吸收SO2。欲消除生成的硫酸,可选用的试剂A是______(填字母)。
A.MnCO3 B.MnO2 C.Mn(OH)2 D.MnSO4
(4)操作I的目的是__________和调节溶液的pH至3~4。检验过滤后的滤液中是否含有Fe3+的操作是_______________。
【答案】 漏斗 MnO2+SO2 =Mn2++ SO42- AC 用MnO2将Fe2+氧化成Fe3+ 取少量滤液,滴加KSCN溶液,若不显红色,则过滤后的溶液中不含Fe3+
【解析】(1)实验室进行过滤操作时用到的玻璃仪器有玻璃棒、烧杯和漏斗,故答案为:漏斗;
(2)浸出后,锰主要以Mn2+的形式存在,则MnO2与SO2反应将二氧化硫氧化为硫酸根,反应的离子方程式为MnO2+SO2 =Mn2++ SO42-,故答案为:MnO2+SO2 =Mn2++ SO42-;
(3)浸出过程的副反应之一是部分SO2被氧化为硫酸,致使浸出液的pH下降,这将不利于软锰矿浆继续吸收SO2。A.MnCO3可以与硫酸反应生成二氧化碳和硫酸锰,正确;B.MnO2与硫酸不反应,错误;C.Mn(OH)2与硫酸发生中和反应生成硫酸锰,正确;D.MnSO4与硫酸不反应,错误;故选AC;
(4)根据流程图,操作I中二氧化锰将Fe2+氧化成Fe3+,然后调节溶液的pH至3~4,使铁离子沉淀除去;检验过滤后的滤液中是否含有Fe3+,可以取少量滤液,滴加KSCN溶液,若不显红色,则过滤后的溶液中不含Fe3+,故答案为:用MnO2将Fe2+氧化成Fe3+;取少量滤液,滴加KSCN溶液,若不显红色,则过滤后的溶液中不含Fe3+。


科目:高中化学 来源: 题型:
【题目】设NA 为阿伏加德罗常数的值。下列说法正确的是
A. 标准状况下,11.2 L苯中所含C-H键数目为3NA
B. 7.8g Na2S和Na2O2组成的混合物,所含阴离子总数为0.1NA
C. 1 mol Cl2发生反应时,转移的电子数一定为2NA
D. 常温下,pH=2的H2SO4溶液中所含H+数目为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识完成下面题目:
(1)某有机物含碳85.7%、氢14.3%,向80g含溴5%的溴水中通入该有机物,溴水恰好完全褪色,此时液体总重81.4g.①该有机物的分子式:;
②经测定该有机物分子中有两个﹣CH3 , 写出它的结构简式: , .
(2)某烃的相对分子质量为92,该烃不能使溴的四氯化碳溶液褪色,能使酸性高锰酸钾褪色.回答下列问题:①写出该烃与硝酸反应的化学方程式:;
②该烃与氢气加成反应产物的1H核磁共振谱图中有种不同化学位移的氢原子.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水溶液一定呈中性的是( )
A.c(NH4+)=c(Cl﹣)的NH4Cl和氨水的混合溶液
B.c(H+)=1.0×10﹣7molL﹣1的溶液
C.pH=7的溶液
D.室温下将pH=3的酸与pH=11的碱等体积混合后的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和镍及其化合物是重要的合金材料和催化剂,其储氢合金可作为一种新型锌离子电池的负极材料,该电池以Zn(CF3SO3)2为电解质,以有缺陷的阳离子型ZnMn2O4为电极,成功获得了稳定的大功率电流。
(1)基态钒原子的价电子排布式为_______,其排布时能量最高的电子所占据能级的原子轨道有_______个伸展方向。
(2)VO2+与 可形成配合物。
可形成配合物。 中,三种非金属元素的电负性由大到小的顺序为_______ (用元素符号表示)。
中,三种非金属元素的电负性由大到小的顺序为_______ (用元素符号表示)。
(3)镍形成的配离子[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子的空间构型为_______。与CN-互为等电子体的一种分子的化学式为________ 。
(4)三氟甲磺酸(CF3SO3H)是一种有机强酸,结构式如图1所示,通常以CS2、IF5、H2O2等为主要原料来制取。
①H2O2分子中O原子的杂化方式为_______。
②三氟甲磺酸能与碘苯反应生成三氟甲磺酸苯酯和碘化氢。1个三氟甲磺酸苯酯分子中含有σ键的数目为_______。
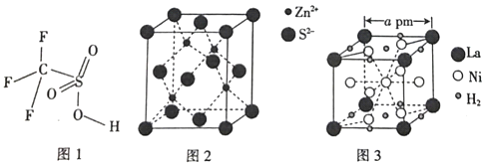
(5)硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图2所示,该晶胞中S2-的配位数为_________。
(6)镧镍合金是重要的储氢材料,其储氢后的晶胞如图3所示。
①储氢前该镧镍合金的化学式为_________。
②该镧镍合金储氢后氢的密度为_________(用NA表示阿伏加德罗常数的数值)g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苄丙酮香豆素(H)常用于防治血栓栓塞性疾病,其合成路线如图所示(部分反应条件略去)。

已知:
回答下列问题:
(1)A的名称是_________,H 中含氧官能团的名称是_________ 。
(2)反应①的反应类型是_________,反应④的反应类型是_________ 。
(3)C 的结构简式为_________ 。
(4)反应⑤的化学方程式为_________ 。
(5)F 的同分异构体中,满足下列条件的有_____种,其中核磁共振氢谱有7组峰,且峰面积之比为1:2:2:2:2:1:2的结构简式为__________。(任写一种)
①分子结构中除苯环外不含其他环,且不含甲基
②能和FeCl3溶液发生显色反应
③1mol该有机物能与2molNaOH 恰好完全反应
(6)参照苄丙酮香豆素的合成路线,设计一种以E和乙醛为原料(其他无机试剂任选)制备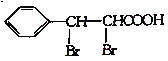 的合成路线。_____________
的合成路线。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关乙烯的叙述中,不正确的是( )
A.乙烯的化学性质比乙烷活泼
B.乙烯燃烧时火焰明亮,并产生黑烟
C.乙烯可用作香蕉等果实的催熟剂
D.乙烯双键中的一个键可以断裂,容易发生加成反应和取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com