
【题目】碱式氯化铜[CuaClb(OH)cH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应后生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示
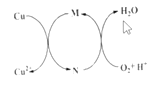
步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。下列有关说法正确的是( )
A.a、b、c之间的关系式为:a=b+c
B.图中M、N分别为Fe2+、Fe3+
C.步骤1充分反应后,加入CuO是为了除去Fe3+
D.若制备1molCuCl2,理论上消耗11.2LO2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】化合物A 经李比希法和质谱法分析得知其相对分子质量为 136,分子式为 C8H8O2。A 的核磁共振氢谱有 4 个峰且面积之比为 1:2:2:3,A 分子中只含一个苯环且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如下图。关于A 的下列说法中,正确的是( )
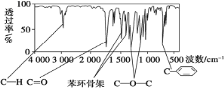
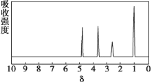
A.与 A 属于同类化合物的同分异构体只有 2 种
B.符合题中A 分子结构特征的有机物只有 1 种
C.A 分子属于酯类化合物,在一定条件下不能发生水解反应
D.A 在一定条件下可与 4molH2 发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物E(二乙酸-1,4-环己二醇酯)是一种制作建筑材料的原料。其合成路线如下:

完成下列填空:
(1)A中含有的官能团是______;E的分子式是______;试剂a是______。
(2)写出反应类型:B→C______。
(3)C与D反应生成E的化学方程式:______。
(4)C的同分异构体,能使石蕊试剂显红色,写出该物质的一种结构简式______。
(5)设计一条以环己醇(![]() )为原料(其他无机试剂任取)合成A的合成路线。
)为原料(其他无机试剂任取)合成A的合成路线。
(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)_____________________
目标产物)_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.向0.1mol![]() CH3COOH溶液中加入少量水,溶液中
CH3COOH溶液中加入少量水,溶液中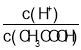 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中![]() >1
>1
D.将0.1mol/L的NaOH的温度提高至80℃,溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所使用的装置(夹持装置略)、试剂和操作方法有错误的是()
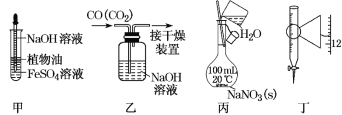
A.用装置甲观察Fe(OH)2的生成
B.用装置乙除去CO中的CO2
C.用装置丙配制一定物质的量浓度的NaNO3溶液
D.装置丁为25mL滴定管,读数为11.80mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Ca、Cu、Fe四种金属元素组成。请回答下列问题:
(1)基态铁原子价电子排布式为_________,从结构角度来看,Fe2+易被氧化成Fe3+的原因是________________。
(2)SCN-离子可用于 Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与 SCN-互为等电子体的一种微粒_____(分子或离子);
②硫氰酸分子中硫原子的杂化方式为_____。
③异硫氰酸的沸点比硫氰酸沸点高的原因是____________________________。
(3)新制的Cu(OH)2可溶于过量的氨水,生成的配合物[Cu(NH3)4](OH)2中含有的化学键类型有 _____________________,1 mol该物质中含有 ____________________个σ键。
(4)CaF2晶体的晶胞如图所示。已知:CaF2晶体的密度为ρ g·cm-3,NA代表阿伏加德罗常数的值。CaF2晶体中Ca2+和F-之间的最近核间距(d)为 ______________pm(列出计算式即可)。
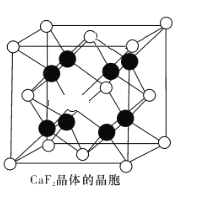
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置符合实验目的是( )
目的 | 粗铜的精炼 | 验证NaCl溶液(含酚酞)的产物 | 在铁制品上镀铜 | 构成原电池 |
装置 |
|
|
|
|
选项 | A | B | C | D |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中,可以使0.10mol/LCH3COOH溶液中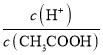 值增大的措施是_______________(填序号)。
值增大的措施是_______________(填序号)。
a.加水稀释b.加入少量CH3COONa固体 c.加入少量冰醋酸d.通入少量HCl气体 e.加少量烧碱溶液 f.升高温度
(2)t℃时,水的离子积常数Kw=1×10-12。
①该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液混合后溶液呈中性,则a+b=_________。
②该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因:_______________________;该混合溶液中:c(A-)-c(Na+)=______________________mol/L(填数值)。
(3)25℃下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3;b.NaClO;c.CH3COONa。(已知25℃时电离常数:H2CO3 K1=4.4×10-7,K2=4.7×10-11;HClO K=3.0×10-8;CH3COOH K=1.8×10-5)
①三种溶液pH由小到大的顺序为:_______________________________(填序号)。
②溶液a的pH大于8,则溶液中c(H2CO3)_____c(CO32-)(填“>”、“<”或“=”)。
(4)已知25℃时,Ksp(AgCl)=1.8×10-10,现将足量氯化银分别放入:
a.100mL蒸馏水中;
b.100mL0.2mol/LAgNO3溶液中;
c.100mL0.1mol/L氯化铝溶液中;
d.100mL0.1mol/L盐酸溶液中。
充分搅抖后,相同温度下银离子浓度由大到小的顺序是________________(填写序号);b中氯离子的浓度为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有效去除大气中的NOx和SO2是环境保护的重要课题。
(1)酸性条件下,NaClO2吸收NO的相关热化学方程式如下:
4NO(g) + 3NaClO2(aq) + 2H2O(l) = 4HNO3(aq) + 3NaCl(aq) ΔH= a kJ·mol1
5NaClO2(aq) + 4HCl(aq) = 4ClO2(g) + 2H2O(l) + 5NaCl(aq) ΔH= b kJ·mol1
反应5NO(g) + 3ClO2(g) + 4H2O(l) = 5HNO3(aq) + 3HCl(aq) ΔH=________kJ·mol1。
(2)用电解法处理氮氧化物可回收硝酸。实验室模拟电解NO2的装置如图-1所示。写出电解时阳极的电极反应式:________。
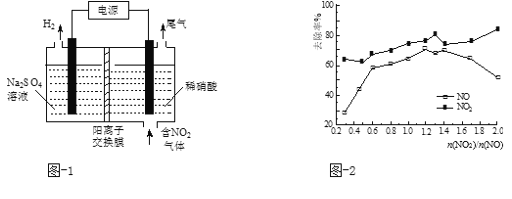
(3)用CO(NH2)2水溶液吸收SO2并通入O2,反应生成(NH4)2SO4和CO2。写出该反应的化学方程式:___________。
(4)利用活性焦炭的吸附作用,可以对烟气进行脱硫和脱硝。被吸附的NO2与活性焦炭反应生成N2和CO2,当生成1 mol N2时,转移的电子数为_________mol。
(5)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入0.05 mol·L1的Ca(OH)2乳浊液中,发生的反应为:3NO2 + 2OH-= NO +2NO3-+ H2O;NO + NO2 +2OH-= 2NO2- + H2O。改变![]() ,NOx的去除率见图-2。
,NOx的去除率见图-2。
①![]() 的合适范围是___________________。
的合适范围是___________________。
②当![]() 大于1.4时,NO2去除效率升高,但NO去除效率却降低。其可能的原因是______ 。
大于1.4时,NO2去除效率升高,但NO去除效率却降低。其可能的原因是______ 。
③O3和NO发生的主要反应为:NO + O3 = NO2 + O2。保持NO的初始浓度不变,改变![]() ,将反应后的混合气体通入0.05mol·L1Ca(OH)2乳浊液中吸收。为节省O3的用量,又能保持NOx去除效果,则
,将反应后的混合气体通入0.05mol·L1Ca(OH)2乳浊液中吸收。为节省O3的用量,又能保持NOx去除效果,则![]() 合适的值约为_________。
合适的值约为_________。
a.0.6 b.0.8 c.1.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com