
五种短周期元素A、B、C、D、E、F的原子序数依次增大,A和C同族,B和D 同族,C离子和B离子具有相同的电子层结构。A和B、D、E、F均能形成共价化合物。A和B形成的化合物在水中呈碱性。回答下列问题:
(1)五种元素中,原子半径最大的元素在周期表中的位置:__________________,非金属性最强的元素其原子结构示意图为:__________________________;
(2)能说明E、F非金属性强弱的事实是___________________(用一个化学方程式举例);
(3)用电子式表示C、E元素组成的化合物的形成过程:____________________________;
(4)由A和B、D、E、F所形成的共价化合物中,热稳定性最差的是_______(用化学式表示);
(5)D在不充足的F中燃烧,生成的主要产物的结构式为_________________________;
(6)A和F形成的化合物与A和B形成的化合物反应,产物的电子式为_________________,其中存在的化学键类型为___________________________;
(7)写出F的同主族短周期元素的单质与水反应的化学方程式___________________________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2017届陕西省高三3月月考理科综合化学试卷(解析版) 题型:选择题
化学离不开生活,生活也离不开化学。下列叙述中科学的是
A. 广告语“农家肥蔬菜,无公害,绝对不含任何化学物质”
B. 医用酒精是利用了乙醇的氧化性来杀菌消毒的
C. 面食加工时加入少量苏打粉时是防止酸败,加入少量小苏打粉时是作膨松剂
D. 空气质量日报中计入污染指数的项目为可吸入颗粒物、SO2、NOx、CO2
查看答案和解析>>
科目:高中化学 来源:2017届新疆乌鲁木齐地区高三第二次诊断性测验化学试卷(解析版) 题型:简答题
硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿( PbS)直接制备硫酸铅粉末的流程如下:
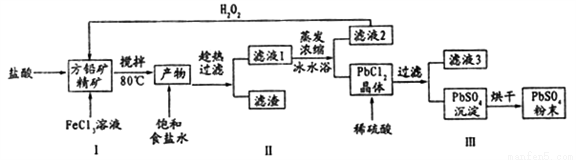
已知:(i) PbCl2 (s)+2C1-(aq)=PbCl42-(aq) △H>0
(ii)有关物质的Ksp和沉淀时的pH如下:
物质 | Ksp | 物质 | 开始沉淀时pH | 完全沉淀时pH |
PbSO4 | 1.0×10-8 | Fe(OH)3 | 2.7 | 3.7 |
PbCl2 | 1.6×10-5 | Pb(OH)2 | 6 | 7.04 |
(1)步骤I反应加入盐酸后可以观察到淡黄色沉淀生成,请写出的离子方程式___________。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因____________。
(3)在上述生产过程中可以循环利用的物质有______________。
(4)写出步骤Ⅲ中PbCl2晶体转化为PbSO4沉淀的离子方程式________________。
(5)铅的冶炼、加工会使水体中重金属铅的含量增大造成严重污染。某课题组制备了一种新型脱铅剂(用EH表示),能有效去除水中的痕量铅,脱铅过程中主要发生的反应为:2EH(s)+Pb2+ E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
E2Pb(s)+2H+。则脱铅的最合适的pH范围为____(填编号)
A.4~5 B.6~7 C.9~10 D.11~12
(6)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KC1混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca=CaCl2+Li2SO4+Pb。
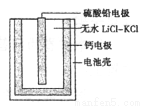
①放电过程中,Li+向_______移动(填“负极”或“正极”)。
②负极反应式为_____________。
③电路中每转移0.2mol电子,理论上生成_________g Pb。
查看答案和解析>>
科目:高中化学 来源:南开中学2016-2017高三第四次月考理综化学试卷 题型:填空题
重铬酸钾(K2Cr2O7)是高中化学常见的氧化剂,工业上以铬铁矿为原料用碱溶氧化法制备。铬铁矿中通常含有Cr2O3、FeO、Al2O3、SiO2等。
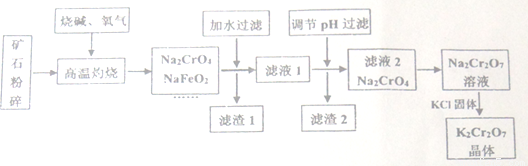
已知:①NaFeO2遇水强烈水解②2CrO42-(黄色) + 2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
请回答下列问题:
(1)将矿石粉碎的目的是________;高温灼烧时Cr2O3发生反应的化学方程式为__________。
(2)滤渣1中有红褐色物质,写出生成该物质反应的离子方程式________。滤渣2的主要成分是A1(OH)3和______________。
(3)用简要的文字说明Na2Cr2O7溶液中加入KC1固体,降温析出K2Cr2O7的原因_______。
(4) 25°C时,对反应2CrO42-(黄色)+2H+ Cr2O72- (橙色)+H2O,取Na2CrO4溶液进行实验,测得部分实验数据如下:
Cr2O72- (橙色)+H2O,取Na2CrO4溶液进行实验,测得部分实验数据如下:
时间/ (S) | 0 | 0.01 | 0.02 | 003 | 0.04 |
(CrO42-)/ (mol·L-1) | 0.20 | 1.6×10-2 | 1.2×10-2 | 1.0×10-2 | |
(Cr2O72-)/ (mol·L-1) | 0 | 9.2×l0-2 | 9.4×10-2 | 9.5×10-2 |
反应达到平衡时,溶液的pH=l,该反应平衡常数K为______。
②下列有关说法正确的_____________。
a.加少量NaHCO3固体,可使溶液的橙色加深
b.0.03 s时v(CrO42-)(正)=2v(Cr2O72-)(逆)
c.溶液中c(CrO42-):c(Cr2O72-)=2 : 1时该反应己达平衡状态
d.反应达到平衡时CrO42-的转化率为95%
查看答案和解析>>
科目:高中化学 来源:南开中学2016-2017高三第四次月考理综化学试卷 题型:选择题
下列说法不正确的是
A. 放热反应在常温下不一定能够自发进行
B. 合成氨反应需使用催化剂,目的是促进该反应平衡向生成氨的方向移动
C. 0.1mol·L-1Na2CO3溶液在35°C时碱性比25°C强,说明Na2CO3水解是吸热反应
D. MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)<Ksp(MnS)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考试化学试卷(解析版) 题型:选择题
某白色粉末由两种物质组成,为鉴别其成分进行如下实验:
①取少量样品加入足量水仍有部分固体未溶解;再加入足量稀盐酸,有气泡产生,固体全部溶解;
②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。
该白色粉末可能为
A. NaHCO3、Al(OH)3 B. AgCl、NaHCO3
C. BaCO3、Na2SO3 D. CuSO4、Na2CO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A. 钠投入氯化亚铁溶液中:2Na+Fe2+===2Na++Fe
B. AlCl3溶液中加入过量的氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
C. Fe3O4溶于稀硝酸中:Fe3O4+8H+===Fe2++2Fe3++4H2O 
D. 澄清石灰水中加入过量的NaHCO3溶液:Ca2++OH-+HCO3-===CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:广西南宁市2017届高三第一次模拟测试理综化学试卷 题型:选择题
用NA表示阿伏伽德罗常数的数值,下列说法正确的是
A. 9.8g由H2SO4和H3PO4组成的混合物含有的氧原子数为0.4NA
B. 1molNa218O2中所含的中子数为42NA
C. 28g铁粉与足量稀硝酸反应,转移的电子数为NA
D. 1mol环己烷中含有的共价键数为12NA
查看答案和解析>>
科目:高中化学 来源:2017届福建省厦门市高三下学期第一次质量检测理综化学试卷(解析版) 题型:选择题
化学在生活中应用广泛,下列物质性质与对应用途错误的是
A. 明矾易水解生成胶体,可用作净水剂 B. 晶体硅熔点高硬度大,可用作芯片
C. 氮气化学性质稳定,可用作粮食保护气 D. 溴化银见光易分解,可用作胶片感光剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com