
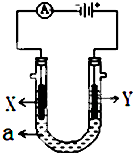
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
| ||
| ||
| 1.12L |
| 22.4L/mol |
| m |
| n |
| 3.2g |
| 0.05mol |


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
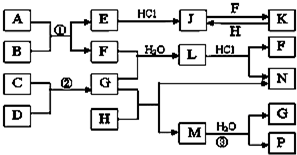 如图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产物已略去).
如图是部分常见元素的单质及其化合物的转化关系图(有关反应条件及生成的部分产物已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
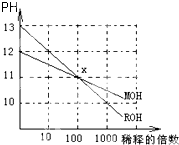 MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是( )
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示.下列叙述中正确的是( )| A、等PH的MOH和ROH溶液,稀释相同倍数,ROH 溶液的PH略大 |
| B、稀释前,c(ROH)=10c(MOH) |
| C、常温下pH之和为14的醋酸和ROH溶液等体积混合,溶液呈碱性 |
| D、在x点,c(M+)=c(R+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol |
| B、3 mol |
| C、5 mol |
| D、7 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
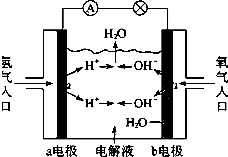
| A、a电极是负极 |
| B、电子从b电极流向a电极 |
| C、在电池工作中,a电极附近pH值降低 |
| D、b电极的电极反应为:4OH--4e-═2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应必然伴随发生能量变化,其能量变化主要是由化学键变化引起的 |
| B、化学反应中能量变化的大小与反应物的质量多少无关 |
| C、101kPa下,1mol的纯物质完全燃烧生成稳定的氧化物时的反应热叫燃烧热 |
| D、酸碱稀溶液中和生成1mol水时的反应热叫中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
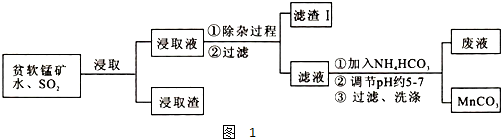
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| 氢氧化铁 | 2.7 | 3.7 |
| 氢氧化铝 | 3.3 | 5.2 |
| 氢氧化亚铁 | 7.6 | 9.6 |
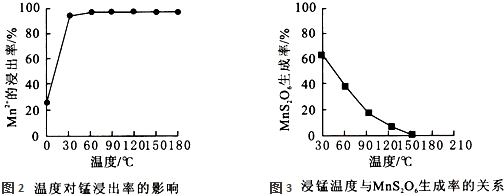
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8 | B、6 | C、4 | D、2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com