
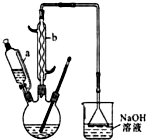
 ������
������ 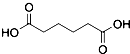 ��һ�ֹ�ҵ�Ͼ�����Ҫ������л���Ԫ�ᣬ�ڻ����������л��ϳɹ�ҵ��ҽҩ��������ȷ��涼����Ҫ���ã��ܹ��������η�Ӧ��������Ӧ�ȣ��������Ԫ�����۳ɸ߷��Ӿۺ���ȣ���������������ж�Ԫ�����еĵڶ�λ��ʵ���Һϳɼ�����ķ�Ӧԭ����ʵ��װ��ʾ��ͼ��
��һ�ֹ�ҵ�Ͼ�����Ҫ������л���Ԫ�ᣬ�ڻ����������л��ϳɹ�ҵ��ҽҩ��������ȷ��涼����Ҫ���ã��ܹ��������η�Ӧ��������Ӧ�ȣ��������Ԫ�����۳ɸ߷��Ӿۺ���ȣ���������������ж�Ԫ�����еĵڶ�λ��ʵ���Һϳɼ�����ķ�Ӧԭ����ʵ��װ��ʾ��ͼ�� +8HNO3��3
+8HNO3��3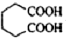 +8NO��+7H2O
+8NO��+7H2O| ���� | �ܶȣ�20�棩 | �۵� | �е� | �ܽ��� | ��Է������� |
| ������ | 0.962g/cm3 | 25.9�� | 160.8�� | 20��ʱˮ���ܽ��3.6g���ɻ������Ҵ����� | 100 |
| ������ | 1.36g/cm3 | 152�� | 337.5�� | ��ˮ�е��ܽ�ȣ�15��ʱ1.44g��25��ʱ2.3g���������Ҵ��������ڱ��� | 146 |
���� ��1����Һ©����ϸ֧��a��ʹ����ƿ�е�����ͨ��a�����Һ©���Ϸ����Ӷ�ʹ��Һ˳�����£�����b������Ϊ�����������ܣ��������ܣ���
��2���÷�Ӧ���ȣ���Ӧ�¶ȸߣ�������Һ���У�������������ը�����������ж�������Ⱦ������
��3������Ԫ���غ㣬������NO��NO2��Ӧ������NaNO2��NaNO3���ҷų�CO2���ݴ�д��Ӧ�Ļ�ѧ����ʽ��
��4����Ʒ�������к��л���������������ʣ���������ˮ�е��ܽ�ȣ�15��ʱ1.44g��25��ʱ2.3g���������Ҵ��������ڱ���
��5���ֲ�Ʒ�����ܽ�Ȳ�𣬿���ͨ���ؽᾧ�ᴿ����Ӧ�Ļ�����Ϊ5.4mL������=5.4ml��0.962g/ml=5.1948g����ϻ�ѧ����ʽ�������������ɼ�������������������������
��� �⣺��1����Һ©����ϸ֧��a��ʹ����ƿ�е�����ͨ��a�����Һ©���Ϸ���ͨ����Һ©�����·�����ѹǿ���ʹ��Һ˳�����£�����b������Ϊ�����������ܣ�
�ʴ�Ϊ�����������ܣ��������ܣ���
��2��������ƿ�еμӻ�����ʱ����Ӧ�¶�Ѹ��������˵���÷�ӦΪ���ȷ�Ӧ������ƺû������ĵ������ʣ�����������ĵ������ʹ��죬��Ӧ�¶ȸߣ���ӦҺ���г�������ܣ���������ը�����������ж�������ֱ���ſգ���������Ķ���������������������Һ���ն����ݵ������ж���Ⱦ������
�ʴ�Ϊ����ӦҺ���г�������ܣ����ȹ����������ը��������NO2��������������Һ���ն����ݵ������У�
��3������Ԫ���غ㣬������NO��NO2��Ӧ������NaNO2��NaNO3���ҷų�CO2����Ӧ�Ļ�ѧ����ʽΪNa2CO3+2NO2�TNaNO2+NaNO3+CO2��NO+NO2+Na2CO3�T2NaNO2+CO2��
�ʴ�Ϊ��2NO2+Na2CO3=NaNO2+NaNO3+CO2��NO+NO2+Na2CO3=2NaNO2+CO2��
��4����Ʒ�������к��л���������������ʣ���������ˮ�е��ܽ�ȣ�15��ʱ1.44g��25��ʱ2.3g���¶ȸ��ܽ�ȴ��ñ�ˮϴ�ӣ���ȥ�����������ᣬ��������ڱ�������ñ�ϴ�Ӿ��壬��ȥ��������ʣ������Ʒ��ʧ��
�ʴ�Ϊ������
��5���ֲ�Ʒ���ܽ⣬�ٽᾧ������ͨ���ؽᾧ�ķ����ᴿ�����ᣬ
��Ӧ�Ļ�����Ϊ5.4mL������=5.4ml��0.962g/ml=5.1948g�������ɼ����������Ϊm��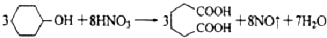
3��100 3��146
5.1948g m
3��100��3��146=5.1948g��m
m=$\frac{3��146��5.1948g}{3��100}$=7.58g
���������=$\frac{5.7g}{7.58g}$��100%=75%��
�ʴ�Ϊ���ؽᾧ��75%��
���� ���⿼�������Ʊ���Ϊ��Ƶ���㣬�漰���ʵķ������ᴿ���Բ����ķ������ۡ���ѧ����ʽ�ļ���ȣ�����ʵ�����������֪ʶ�ۺ�Ӧ�������Ŀ��飬�ۺ��Խ�ǿ���Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ������� | ��ʼʱ���������ʵ���/mol | ��ƽ�������ϵ �����ı仯 | ||||
| CO | H2O | CO2 | H2 | |||
| �� | 1 | 4 | 0 | 0 | �ų�������32.8kJ | |
| A�� | �������з�Ӧ��ƽ��ʱ��CO��ת����Ϊ80% | |
| B�� | ƽ��ʱ����������CO2��Ũ����� | |
| C�� | ��������CO��ת���ʵ�����������CO2��ת���� | |
| D�� | ��������CO��Ӧ���ʵ���H2O��g���ķ�Ӧ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
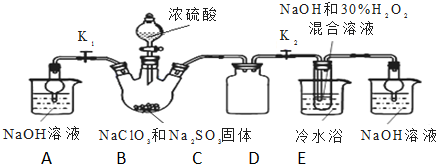
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
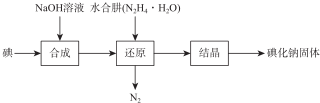
| �ⶨ ��� | ����Һ���/mL | ��Һ�ζ���������/mL | ��Һ�ζ����յ����/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
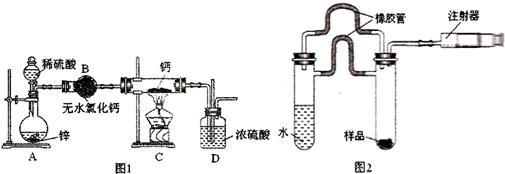
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
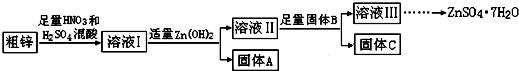
| ���� | Fe��OH��3 | Cu��OH��2 | Zn��OH��2 | CuS | ZnS |
| Ksp | 4.0��10-38 | 5.0��10-20 | 2.0��10-16 | 8.5��10-45 | 1.2��10-23 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
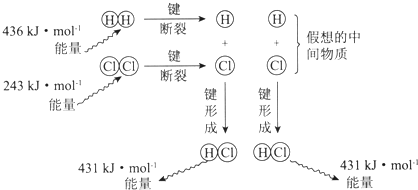
| A�� | �÷�Ӧ�ķ�Ӧ�ȡ�H=-183kJ•mol-1 | |
| B�� | �÷�Ӧ����Һ̬HCl��������̬HCl�ͷŵ������� | |
| C�� | ���������еĻ�ѧ�������������еĻ�ѧ�����ȶ� | |
| D�� | 1 mol HCl�����еĻ�ѧ���γ�ʱ����431kJ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | BaCl2��Һ��K2SO4��Һ��Ӧ | B�� | Al�����ռ���Һ�� | ||
| C�� | NaOH��Һ��CuSO4��Һ��Ӧ | D�� | KSCN��Һ��FeCl3��Һ��Ӧ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com