
【题目】A,B,X,Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物;B与Z的最外层电子数之比为2:3,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题.
(1)Z的原子结构示意图为;化合物BA4的电子式为 .
(2)化合物Y2X2中含有的化学键类型有(填序号).
A.离子键
B.极性共价键
C.非极性共价键
D.氢键
(3)化合物A2X和A2Z中,沸点较高的是(填化学式),其主要原因 .
(4)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应的化学方程式为 .
【答案】
(1)![]() ;
;![]()
(2)AC
(3)H2O;H2O中存在氢键
(4)H2O2+H2S═2H2O+S↓
【解析】解:A与B和A与X均可形成10个电子化合物,则A应为H元素,A与Y同主族,则Y为Na元素,常见化合物Y2X2与水反应生成X的单质,其溶液可使酚酞试液变红,则X为O元素,Y2X2为Na2O2 , X与Z同主族,则Z为S元素,B与Z的最外层电子数之比为2:3,则B元素的最外层电子数为4,根据A、B、X、Y和Z是原子序数依次递增的短周期元素,B应为C元素,(1)Z为S元素,核电核数为16,原子核外有3个电子层,最外层电子数为6,则原子结构示意图为 ![]() ,化合物BA4为CH4 , 为共价化合物,电子式为
,化合物BA4为CH4 , 为共价化合物,电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ,
, ![]() ;(2)Y2X2为Na2O2 , 为离子化合物,化合物中含有过氧键,氧原子之间为非极性共价键,所以答案是:AC;(3)O原子半径较小,非金属性较强,H2O存在氢键,沸点在同主族元素中形成的氢化物最高,所以答案是:H2O;H2O中存在氢键;(4)A与X和A与Z均能形成18个电子的化合物,这两种化合物分别为H2O2和H2S,H2O2具有氧化性,H2S具有还原性,二者发生氧化还原反应生成H2O和S,反应的方程式为H2O2+H2S═2H2O+S↓,所以答案是:H2O2+H2S═2H2O+S↓.
;(2)Y2X2为Na2O2 , 为离子化合物,化合物中含有过氧键,氧原子之间为非极性共价键,所以答案是:AC;(3)O原子半径较小,非金属性较强,H2O存在氢键,沸点在同主族元素中形成的氢化物最高,所以答案是:H2O;H2O中存在氢键;(4)A与X和A与Z均能形成18个电子的化合物,这两种化合物分别为H2O2和H2S,H2O2具有氧化性,H2S具有还原性,二者发生氧化还原反应生成H2O和S,反应的方程式为H2O2+H2S═2H2O+S↓,所以答案是:H2O2+H2S═2H2O+S↓.
【考点精析】掌握极性键和非极性键是解答本题的根本,需要知道非极性键:由同种元素的原子间的原子间形成的共价键(共用电子对不偏移);极性键:由不同元素的原子间形成的共价键(共用电子对偏向吸引电子能力强的一方).


科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素(1-8)在表中的位置,用化学用语回答下列问题:

(1)画出元素⑦的原子结构示意图__________。
(2)写出元素③的气态氢化物的电子式________。写出元素②的单质与元素⑧最高价含氧酸浓溶液的化学反应方程式__________。
(3)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是________。(用元素形成的酸的化学式表示)
(4)①、④、⑤、⑨中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(5)由表中元素形成的物质X、Y、Z、M、N可发生以下反应,其中物质X、Y、N均为两种元素组成的物质。

X溶液与Y溶液反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 H2 和钠反应制备氢化钠的装置如右图所示(Zn 粒中含有少量 ZnS 杂质),下列说法不正确的是

A. ①、 ②中依次盛有浓 NaOH 溶液、 浓 H2SO4
B. 管式炉加热前, 用试管收集③处气体并点燃, 通过声音判断气体纯度
C. 结束反应时, 先停止管式炉加热, 再关闭活塞 K
D. 取出瓷舟内的固体, 投入适量水中, 若有气体产生, 即可证明制得了氢化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米技术”广泛的应用于催化及军事科学中,“纳米技术”是指粒子直径在几纳米到几十纳米的材料。如将“纳米材料”分散到液体分散剂中,所得的混合物具有的性质是( )
A.能全部通过半透膜B.能发生丁达尔现象C.一定能导电D.一定为悬浊液或乳浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中可能含有Fe2+、Fe3+、A13+、Ba2+、NH4+、CO32-、NO3ˉ、SO42-、SiO32-中的若干种,现取X溶液进行连续实验,实验过程及产物如图所示。实验过程中有一种气体为红棕色。
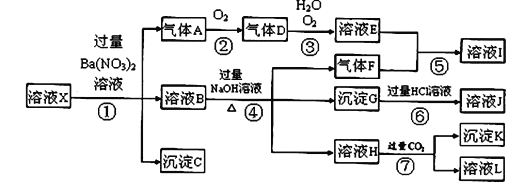
根据以上信息,回答下列问题:
(1)由强酸性条件即可判断X溶液中肯定不存在的离子有____________________。
(2)溶液X中关于硝酸根离子的判断,正确的是_______;(填编号,下同)
a. 一定含有 b. 一定不含有 c.可能含有
(3)气体F的电子式为__________,化合物I中含有的化学键类型有________;
(4)转化⑦的离子方程式为_________________________________________;
(5)对不能确定是否存在的离子,可以另取X溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是_________。
①NaOH溶液 ②KSCN溶液 ③氯水和KSCN的混合溶液 ④pH试纸 ⑤KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“暖宝宝”的主要原料有铁粉、活性炭、水、食盐等,其中活性炭是原电池的电极之一,食盐的作用是溶于水形成电解质溶液.下列有关“暖宝宝”的说法错误的是
A.“暖宝宝”使用前要密封保存,使之与空气隔绝
B.“暖宝宝”放出的热量是铁发生氧化反应时产生的
C.活性炭作用是作原电池正极,加速铁粉的氧化
D.活性炭最终将转化为二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于吸热反应的是( )
A. 锌粒投入稀硫酸中产生氢气 B. 生石灰溶于水
C. 酸碱中和 D. Ba(OH)2·8H2O与NH4Cl晶体混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以丙烯为原料合成抗炎药物D和机体免疫增强制剂Ⅰ的合成路线如下(部分反应条件和产物己经略去):
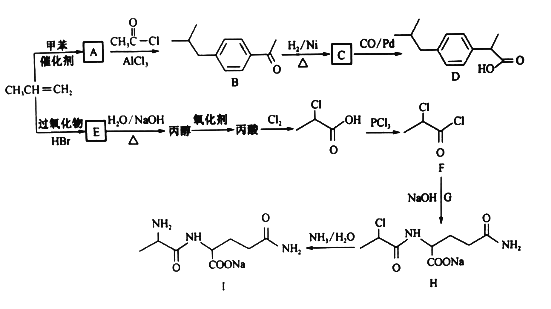
已知: +HCl
+HCl
回答下列问题:
(1)A的结构简式________,由H生成I的反应类型为______________。
(2)E的名称为_____________。
(3)化合物G的化学式为C5H10O3N2,则其结构简式为___________________。
(4)由E生成丙烯的化学方程式为 __________________________________。
(5)分子式为C9H10O2的有机物J和D是同系物,J的结构共有________种。
(6)结合上述流程中的信息,设计由制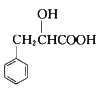 制备
制备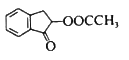 的合成路线:_________________。(其他试剂自选)
的合成路线:_________________。(其他试剂自选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在一个2L的密闭容器中,加入4 molA和2molB进行如下反应:
3A(g)+2B(g)![]() 4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
A. 前2min,D的平均反应速率为0.2mol/(L·min)
B. 此时,B的平衡转化率是40%
C. 增加B,平衡向右移动,B的平衡转化率增大
D. 增大该体系的压强,平衡不移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com