
| A�� | +319.68kJ•mol-1 | B�� | +259.7kJ•mol-1 | C�� | -319.68kJ•mol-1 | D�� | -259.7kJ•mol-1 |
���� ������֪���Ȼ�ѧ��Ӧ����ʽ��˹����������Cu��H2O2��Ӧ����Cu2+��H2O���Ȼ�ѧ����ʽ���ɸ�˹���ɢ�+$\frac{1}{2}$����+�۵õ���Cu��s��+H2O2��l��+2H+��aq���TCu2+��aq��+2H2O��l����H���ɸ�˹���ɿ�֪�÷�Ӧ�ķ�Ӧ�ȡ�H=H1+H2��$\frac{1}{2}$+H3���ݴ˷������
��� �⣺��Cu��s��+2H+��aq���TCu2+��aq��+H2��g����H=+64.39kJ/mol��
��2H2O2��l���T2H2O��l��+O2��g����H=-196.46kJ/mol��
��H2��g��+$\frac{1}{2}$O2��g���TH2O��l����H=-285.84kJ/mol��
�ɸ�˹���ɢ�+$\frac{1}{2}$����+�۵õ���Cu��s��+H2O2��l��+2H+��aq���TCu2+��aq��+2H2O��l����H=+64.39kJ/mol+$\frac{1}{2}$����-196.46kJ/mol��+��-285.84kJ/mol��=-319.68kJ/mol��
��ѡC��
���� ���⿼�鷴Ӧ�ȵ��йؼ��㣬Ϊ��Ƶ���㣬������ѧ���ķ��������ͼ��������Ŀ��飬��ȷ��Ӧ�Ⱥͻ�ѧ�������Ĺ�ϵ�ǽ���ؼ�����Ŀ�ѶȲ���ע���˹���ɵ�Ӧ�ã�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
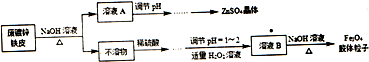
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
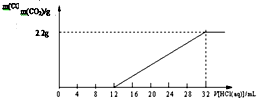 ij̼��غ�̼����صĻ����Ʒ61.4g����ˮ�ܽ��ȡ������Һ��$\frac{1}{10}$�������л�������һ��Ũ�ȵ�ϡ���ᣬ��ͬʱ��¼�ų�CO2������������ϡ�����������õ���ͼ��ʾ�����ߣ�����˵������ȷ���ǣ�������
ij̼��غ�̼����صĻ����Ʒ61.4g����ˮ�ܽ��ȡ������Һ��$\frac{1}{10}$�������л�������һ��Ũ�ȵ�ϡ���ᣬ��ͬʱ��¼�ų�CO2������������ϡ�����������õ���ͼ��ʾ�����ߣ�����˵������ȷ���ǣ�������| A�� | �ù�����������Ӧ�Ļ�ѧ����ʽ��K2CO3+HCl�TKCl+KHNO3��KHNO3+HCl�TKCl+H2O+CO2�� | |
| B�� | �����Ʒ��̼Ԫ�ص���������Ϊ8.5% | |
| C�� | �����Ʒ�к�̼���41.4g | |
| D�� | ��ԭ���Һ���ּ��Ⱥ��ټ������������ᣬ���������в�����CO2�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| A | ����ʹ������Ȼ�̼��Һ��ɫ���ڱ���ģ��Ϊ ��������ˮ��һ�������·�Ӧ����C ��������ˮ��һ�������·�Ӧ����C |
| B | ����C��H����Ԫ����ɣ������ģ��Ϊ |
| C | ����C��H��O����Ԫ����ɣ�������Na��Ӧ����������NaOH��Һ��Ӧ��������E��Ӧ������Է�������Ϊ100���� |
| D | ����Է���������C��2��������C�������ɣ� |
| E | ����C��H��O����Ԫ����ɣ������ģ��Ϊ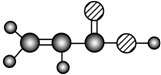 |
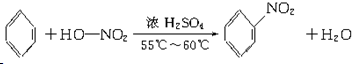 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢۢܢ� | B�� | �٢ۢݢڢ� | C�� | �ڢݢ٢ۢ� | D�� | �ڢ٢ۢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ��Ŀ�� | ѡ���Լ� |
| A | ̽��Cl2��Br2��I2��������ǿ��˳�� | ��ˮ����ˮ��KI��Һ |
| B | ̽����ѧ��Ӧ�������仯 | Ba��OH��2•8H2O��NH4Cl���� |
| C | ֤���������к��е�Ԫ�� | �����ҡ�ϡ���ᡢ3%��H2O2��Һ��������Һ |
| D | ֤�������Ƿ�ˮ�� | ������Һ��ϡ���ᡢNaOH��Һ��������Һ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ζ�������ˮ | |
| B�� | �������ܣ�Na+��K+��NH4+����������������ӷ���ʽ�г��� | |
| C�� | NH4Cl�ķֽ���NH3��HCl�Ļ��ϲ����ڿ��淴Ӧ | |
| D�� | ��ζ�����NaOH��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | b��a��0 | B�� | b��d��0 | C�� | 2a=d��0 | D�� | 2b=c��0 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com