
| A. | 空气中的分子质量变大 | B. | 空气中的分子间隔变小 | ||
| C. | 空气中的分子种类改变 | D. | 空气中的分子数目变少 |
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,任何气体的摩尔体积都约为22.4 L | |
| B. | 1 mol气体的体积若是22.4 L,它必定处于标准状况 | |
| C. | 标准状况下,1molH2和O2混合气体的体积约为22.4 L | |
| D. | 标准状况下,11.2L水中含有分子的数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 某实验需要配制460mL1.0mol/L的稀硫酸,应取该硫酸25.0mL | |
| B. | 足量铜和含2mol溶质的该硫酸在加热条件下反应,标准状况下生成气体的体积约为22.4L | |
| C. | 该硫酸与等质量的水混合所得溶液溶质的物质的量浓度小于9.2mol/L | |
| D. | 该硫酸与等体积的水混合所得溶液的溶质质量分数小于49% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀有气体、尿素、冰水混合物 | B. | 乙醇、浓硫酸、胆矾 | ||
| C. | 金刚石、铁矿石、大理石 | D. | 水银、水蒸气、生铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
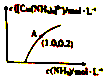 元素铜在溶液中主要以[Cu(H2O)4]2+(天蓝色)、[Cu(OH)4]2-(蓝色)、[CuCl2]-、[Cu(NH3)4]2+(深蓝色)等形式存在.CuCl为难溶于水的白色固体.回答下列问题:
元素铜在溶液中主要以[Cu(H2O)4]2+(天蓝色)、[Cu(OH)4]2-(蓝色)、[CuCl2]-、[Cu(NH3)4]2+(深蓝色)等形式存在.CuCl为难溶于水的白色固体.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁达尔现象可用于区别FeCl3饱和溶液和Fe(OH)3胶体 | |
| B. | 称量时称量物放在称量纸上或玻璃器皿中,置于托盘天平右盘,砝码放在托盘天平的左盘中 | |
| C. | 汽油和水的混合物可用分液的方法分离 | |
| D. | 过滤和蒸发操作中均用到玻璃棒,但玻璃棒的作用不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3俗名小苏打 | |
| B. | 在水中的溶解度:Na2CO3>NaHCO3 | |
| C. | 与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3 | |
| D. | 热稳定性:NaHCO3<Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
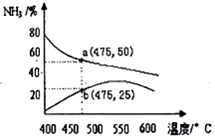 氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.
氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com