
【题目】Ⅰ.运用已学知识完成下列计算:
(1)0.5 mol CH4的质量是________,在标准状况下的体积为________。
(2)3.1 g Na2X含有Na+ 0.1 mol,则X的相对原子质量为________。
Ⅱ.为防治碘缺乏病,通常在食盐中添加少量的碘酸钾(KIO3)。碘酸钾和碘化钾在溶液中能发生下列反应:KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O
(1)该反应中,氧化剂是________,氧化产物是_____。
(2)当有3mol I2生成时,有______mol还原剂被氧化。
(3)用双线桥表示该反应电子转移的方向和数目_______________________。
【答案】8g 11.2L 16 KIO3 I2 5 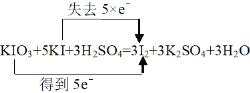
【解析】
Ⅰ⑴0.5 mol CH4的质量是![]() ,在标准状况下的体积为
,在标准状况下的体积为![]() ,故答案为:8g;11.2L;
,故答案为:8g;11.2L;
⑵3.1 g Na2X含有Na+ 0.1 mol,则Na2X的物质的量为0.05mol,则Na2X的摩尔质量为![]() ,23×2 + Mr(X) = 62,Mr(X)=16,因此X的相对原子质量为16,故答案为16;
,23×2 + Mr(X) = 62,Mr(X)=16,因此X的相对原子质量为16,故答案为16;
Ⅱ.⑴KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O中碘酸钾中碘化合价降低,碘化钾中碘化合价升高,单质碘既是升高得到的产物,又是降低得到的产物,因此既是氧化产物又是还原产物,因此该反应中,氧化剂是KIO3,氧化产物是I2;故答案为:KIO3;I2;
⑵KIO3+5KI+3H2SO4=3I2+3K2SO4+3H2O,有3mol I2生成时,有1mol KIO3被还原,有5mol KI被氧化,因此当有3mol I2生成时,有5 mol还原剂被氧化,故答案为:5;
⑶用双线桥表示该反应电子转移的方向和数目 ,故答案为:
,故答案为: 。
。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是( )
A. 1 mol HNO3见光分解,转移电子数4NA
B. 含0.2 mol H2SO4的浓硫酸与足量Cu反应,生成SO2的分子数为0.1NA
C. 100 mL 0.5 mol/L的(NH4)2SO4溶液中,含有0.1NA个NH4+
D. 1 mol Na2O2晶体含有NA个阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
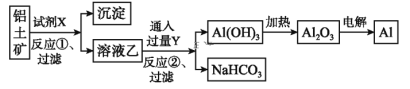
下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 图中所示转化反应都不是氧化还原反应
D. 反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a克Fe2O3、Al2O3样品溶解在过量的200mL pH=1的硫酸溶液中,然后向其中加入NaOH 溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH 溶液100 mL,则NaOH 溶液的浓度为
A. 0.1 mol/LB. 0.2 mol/LC. 0.4 mol/LD. 0.8 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用18.4 mol/L的浓H2SO4来配制500 mL 0.2 mol/L的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥托盘天平 ⑦药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时不需要使用的有___________(填代号),还缺少的仪器是______________________。
(2)经计算,需浓H2SO4的体积为___________,量取浓硫酸时应选用___________(选填①10 mL、②50 mL、③100 mL三种规格)的量筒。
(3)将所配制的稀H2SO4进行测定,发现浓度大于0.2 mol/L。请你分析配制过程中可能引起浓度偏高的原因_____________________ (多选题)
A.定容时液面低于刻度线
B.未冷却到室温就定容
C.定容时液面高于刻度线
D.量取浓硫酸时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为2H2+O2==2H2O,下列有关说法正确的是()

A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-=4OH-
C. 每转移0.1 mol电子,便消耗1.12 升的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍—镉电池是一种可充电的“干电池”,使用寿命长达10~15年。镍—镉电池的总反应为Cd+2NiOOH+2H2O![]() 2Ni(OH)2+Cd(OH)2。下列说法不正确的是( )
2Ni(OH)2+Cd(OH)2。下列说法不正确的是( )
A. 放电时,负极发生了氧化反应,反应为Cd+2OH--2e-===Cd(OH)2
B. 充电时,阳极反应为Ni(OH)2(s)-e-+OH-(aq)===NiOOH(s)+H2O(l)
C. 电池工作时,负极区pH增大,正极区pH减小
D. 该电池充电时将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知 Fe3+在 ph=5时沉淀完全).其中分析错误的是

A. 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B. 步骤②可用氯水、硝酸等强氧化剂代替H2O2
C. 步骤③用 CuCO3代替CuO也可调节溶液的pH
D. 步骤⑤ 的操作为:向漏斗中加入少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有OH-、CO32-、A1O2-、SiO32-、SO42-、HCO3-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是

A. 原溶液中可能含有Na2SO4、可能不含有CO32-
B. 原溶液中一定含有的阴离子只有:OH-、A1O2-、CO32-
C. 原溶液中含CO32-与A1O2-的物质的量之比为3:4
D. a-d>3/4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com