
| A. | 随着元素原子序数的递增,原子最外层电子数总是从 1~8 重复出现 | |
| B. | 随着原子序数的递增,元素的最高正化合价从+1到+7,负价从-7到-1重复出现 | |
| C. | 第3周期中,随着核电荷数的递增,元素的离子半径依次减小 | |
| D. | 随核电荷数递增,ⅦA族元素单质熔、沸点升高,碱金属元素单质熔、沸点降低 |
分析 A.在第一周期,随着元素原子序数的递增,原子最外层电子数总是从1到2;
B.元素的最低负价是-4价,最高正价是+7价;
C.第三周期元素的离子半径,电子层越多,半径越大,具有相同电子排布的离子,原子序数大的离子半径小;
D.卤族元素由上到下,对应单质的相对分子质量逐渐增大,则单质的沸点升高,碱金属都属于金属晶体,其单质的熔沸点随着核电荷数的增大而减小.
解答 解:A.从第二周期开始,随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现,而在第一周期,随着元素原子序数的递增,原子最外层电子数总是从1到2,故A错误;
B.元素的最低负价是-4价,最高正价是+7价,随着元素原子序数的递增,一般情况下元素的最高正价从+1到+7,负价从-4到-1重复出现,故B错误;
C.第三周期元素的离子半径,电子层越多,半径越大,具有相同电子排布的离子,原子序数大的离子半径小,所以第三周期元素的离子半径中阴离子半径大于阳离子半径,且铝离子半径最小,故C错误;
D.卤族元素由上到下,对应单质的相对分子质量逐渐增大,分子间作用力增大,则单质的熔沸点升高,碱金属都属于金属晶体,金属阳离子半径增大,对外层电子束缚能力减弱,金属键减弱,所以熔沸点降低,故D正确.
故选D.
点评 本题考查元素在周期表的位置及应用,为高频考点,把握原子结构与元素的位置、元素周期律的实质为解答的关键,侧重于学生的分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
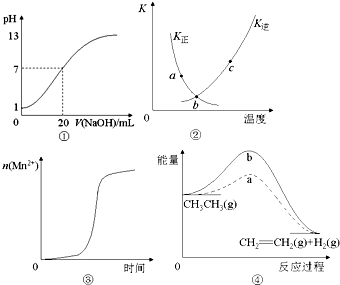
| A. | 图①表示25℃时,用0.1 mol•L-1NaOH溶液滴定20 mL 0.1 mol•L-1 盐酸溶液,溶液的pH随加入NaOH溶液体积的变化 | |
| B. | 图②中表示反应2SO2(g)+O2(g)?2SO3(g);△H<0的有关曲线,图中a.b.c三点中只有b点已经达到化学平衡状态. | |
| C. | 图③表示10 mL 0.01 mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1 H2C2O4 溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用) | |
| D. | 图④中a、b曲线分别表示反应CH3CH3→CH2=CH2 (g)+H2(g);△H>0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入铝粉有氢气生成的溶液中:Mg2+,Cl-,NO3-,K+ | |
| B. | 常温下,c(H+)=0.1 mol/L的溶液中:Na+,AlO2-、S2-、SO32- | |
| C. | 含有0.1 mol/LHCO3-的溶液:Na+,Fe3+,NO3-,SCN- | |
| D. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol/L的溶液:Na+,K+,CO32-,NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在使用过程中,电池负极区溶液的pH增大 | |
| B. | 使用过程中,电子由Ag2O极经外电路流向Zn极 | |
| C. | Zn是负极,Ag2O是正极 | |
| D. | Zn电极发生还原反应,Ag2O电极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
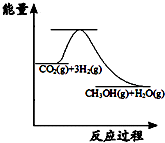 目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);图表示该反应进行过程中能量的变化.(单位为:kJ•mol-1)该反应是放热(填“吸热”或“放热”)反应.△H<0(填“>”或“<”).
目前工业上有一种方法是用CO2来生产甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);图表示该反应进行过程中能量的变化.(单位为:kJ•mol-1)该反应是放热(填“吸热”或“放热”)反应.△H<0(填“>”或“<”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表是元素周期律的具体表现形式 | |
| B. | 元素的性质随原子序数递增而呈现周期性变化的根本原因是随原子序数的递增原子的核外电子排布呈现周期性变化 | |
| C. | 同周期第IA族与第VA族原子序数之差可能是4、14、28 | |
| D. | 同主族原子序数之差不可能是:10、16、18、26、34、36、50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com