

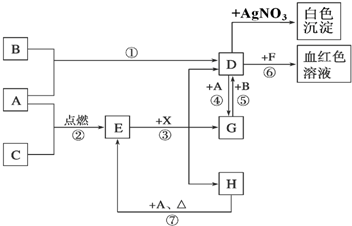
分析 A用于制备SO2,可用Na2SO3与硫酸反应制取,B用于检验二氧化硫的生成,E用浓盐酸和二氧化锰在加热条件下制备氯气,D用于检验气体的漂白性,C用于吸收尾气.
(1)使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出;
(2)实验室用装置E制备Cl2,为二氧化锰和浓盐酸的反应生成氯气;根据化合价的变化计算转移的电子数目;
(3)SO2的漂白具有可逆性,次氯酸的漂白不可逆;
(4)氯气具有较强的氧化性,二氧化硫具有较强的还原性,二氧化硫与氯气等物质的量反应生成盐酸和硫酸,盐酸和硫酸都不具有漂白性.
解答 解:(1)塞子没有取下来,打开活塞时,空气无法进入分液漏斗内部,造成分液漏斗内的压强小于大气压强,液体无法流出,
故答案为:分液漏斗的玻璃塞没有取下来;
(2)实验室用装置E制备Cl2,需加热,为二氧化锰和浓盐酸的反应生成氯气,化学反应为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,离子反应为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,在MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中每有4mol HCl参与反应,被氧化的氯化氢是2mol,即被氧化的氯化氢占参与反应的50%,6 molHCl参加反应被氧化的氯化氢是3mol,转移的电子数为3NA=3×6.02×1023,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑;3×6.02×1023;
(3)次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的.加热时,次氯酸漂白过的溶液无变化,二氧化硫和有色物质生成的无色物质不稳定,加热时会变成红色,
故答案为:褪色的品红又恢复成红色;溶液没有明显变化;
(4)二氧化硫与氯气等物质的量反应生成盐酸和硫酸,盐酸和硫酸都不具有漂白性,化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl;
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl.
点评 本题考查氯气和二氧化硫的漂白性质,题目难度中等,注意掌握氯气和二氧化硫性质,明确二氧化硫的漂白性与次氯酸的漂白性根本区别.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:在酸性条件下发生的反应为AsO43-+2I-+2H+═AsO33-+I2+H2O,在碱性条件下发 生的反应为AsO33-+I2+2OH-═AsO43-+H2O+2I-. 设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
已知:在酸性条件下发生的反应为AsO43-+2I-+2H+═AsO33-+I2+H2O,在碱性条件下发 生的反应为AsO33-+I2+2OH-═AsO43-+H2O+2I-. 设计如图装置(C1、C2均为石墨电极),分别进行下述操作:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.4g D2气体分子含有的中子数小于0.2NA | |
| B. | 含有0.32g氧元素的二氧化硅中含有的硅氧键数目为0.02NA | |
| C. | 11.2L Cl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA | |
| D. | 7.8g过氧化钠粉末与足量二氧化硫反应转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.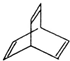 X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有2种.
X与足量的H2在一定条件下反应可生成环状的饱和烃Z,Z的一氯代物有2种. .Y能使溴水褪色,其反应的化学方程式为
.Y能使溴水褪色,其反应的化学方程式为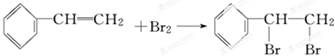 .Y可以用来合成一种聚合物---泡沫塑料,请写出该聚合物的结构简式
.Y可以用来合成一种聚合物---泡沫塑料,请写出该聚合物的结构简式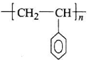 .有机化学中有多种同分异构现象,其中有顺反异构,请写出Y的侧链多一个甲基的有机物W的两种顺反异构的结构简式:
.有机化学中有多种同分异构现象,其中有顺反异构,请写出Y的侧链多一个甲基的有机物W的两种顺反异构的结构简式: ,
,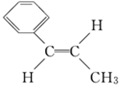 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 4:3:2 | B. | 1:2:1 | C. | 2:1:1 | D. | 1:1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com