
【题目】硼氢化钠(NaBH4)在有机合成、化工生产方面有广泛应用。制备硼氢化钠的化学方程式为NaBO2+2SiO2+4Na+2H2![]() NaBH4+2Na2SiO3。下列有关上述反应的说法错误的是( )
NaBH4+2Na2SiO3。下列有关上述反应的说法错误的是( )
A. 氧化产物和还原产物的物质的量之比为2:1
B. 转移4 mol电子时,只需向装置中通入44.8 L H2(标准状况)
C. 装药品之前加热装置至100℃并持续一会儿
D. 制备硼氢化钠的副产物可能有NaH
【答案】B
【解析】
该反应中H元素化合价由0价变为-1价、Na元素化合价由0价变为+1价,转移电子总数为4,所以反应中钠是还原剂,而氢气是氧化剂,由此分析解答。
A、由反应NaBO2+2SiO2+4Na+2H2![]() NaBH4+2Na2SiO3可知氧化产物为Na2SiO3,还原产物是NaBH4,所以氧化产物和还原产物的物质的量之比为2:1,A正确;
NaBH4+2Na2SiO3可知氧化产物为Na2SiO3,还原产物是NaBH4,所以氧化产物和还原产物的物质的量之比为2:1,A正确;
B、转移4 mol电子时,根据方程式可知理论上需要2mol氢气,在标准状况下的体积为2mol×22.4L/mol=44.8 L,但由于是可逆反应,需要通入氢气的体积大于44.8 L,B错误;
C、由于钠极易被氧化且能与水反应,所以需要排尽装置中的空气和水蒸气,则装药品之前加热装置至100℃并持续一会儿,C正确;
D、由于钠离子可与还原产物生成NaH,因此制备硼氢化钠的副产物可能有NaH,D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】下列有关化学试剂在实验室中的保存方法正确的是
A.钠可放煤油中保存B.可用玻璃细口试剂瓶保存氢氟酸
C.用无色透明试剂瓶保存氯水D.用磨口玻璃塞的试剂瓶保存氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是( )
A. 容量瓶用蒸馏水洗涤干净后没有干燥 B. 定容时仰视
C. 砝码上沾有杂质 D. 没冷却至室温就定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 高能原子轰击
高能原子轰击![]() 的靶子,使锌核与铅核熔合,生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是
的靶子,使锌核与铅核熔合,生成一个112号元素的原子的同时向外释放出一个中子。下列说法错误的是
A. 112号元素的相对原子质量为277
B. 此变化不属于化学变化
C. 科学家合成的112号元素是金属元素
D. 112号元素位于第七周期第ⅡB族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计了如图所示原电池装置(盐桥中吸附有饱和K2SO4溶液)。下列说法正确的是
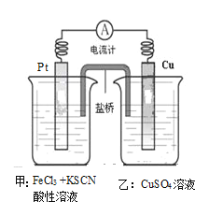
A. 该原电池的正极反应是Cu2++2e-===Cu
B. 甲烧杯中溶液的血红色逐渐变浅
C. 盐桥中的SO42-流向甲烧杯
D. Cu电极质量减少,Pt电极质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图像的解释或结论正确的是
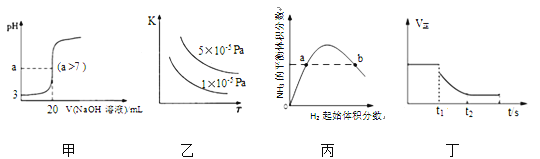
A. 图甲表示常温下向20mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
B. 图乙表示2SO2(g)+O2(g)![]() 2SO3(g) △H<0的平衡常数K与温度和压强的关系
2SO3(g) △H<0的平衡常数K与温度和压强的关系
C. 图丙表示一定条件下的合成氨反应,N2的起始量恒定时,NH3的平衡体积分数随H2起始体积分数的变化,图中a点N2的转化率等于b点
D. 图丁表示反应 2SO2+O2 ![]() 2SO3,t1 时刻降低温度符合图示变化
2SO3,t1 时刻降低温度符合图示变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正确认识和使用电池有利于我们每一个人的日常生活。
I.电化学法处理SO2是目前研究的热点。利用双氧水氧化吸收SO2可消除SO2污染,设计装置如图所示(己知石墨只起导电作用,质子交换膜只允许H+通过)。
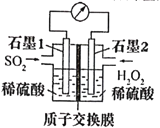
(1)石墨1为____(填“正极”或“负极”),正极的电极反应式为______。
(2)反应的总方程式为_______。
(3)H+的迁移方向为由_____到____。(填“左”或“右”)
(4)若11.2L(标准状况)SO2参与反应,则迁移H+的物质的量为____。
(5)某同学关于原电池的笔记中,不合理的有____。
①原电池两电极材料活泼性一定不同
②原电池负极材料参与反应,正极材料都不参与反应
③Fe-NaOH溶液-Si原电池,Fe是负极
④原电池是将化学能转变为电能的装置
Ⅱ.航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有多种。
(1)某碱式氢氧燃料电池的电解质溶液是KOH溶液,则其负极反应为_____ ;某熔盐氢氧燃料电池的电解质是熔融的碳酸钾,则其负极反应为_____。
(2)氢氧燃料电池用于航天飞船,电极反应产生的水,经过冷凝后可用作航天员的饮用水,当得到1.8g饮用水时,转移的电子数约为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体。m的摩尔质量为p的2倍,n是Y元素的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述物质的转化关系如图所示。下列说法正确的是( )
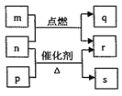
A. q与s均为酸性氧化物B. Z的含氧酸是一种强酸
C. X、Y分别与W形成10e-的微粒能反应生成一种气体D. 原子半径:W<Y<X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(4分)下列应用不涉及氧化还原反应的是( )
A. Na2O2用作呼吸面具的供氧剂
B. 工业上电解熔融状态的Al2O3制备Al
C. 工业上利用合成氨实现人工固氮
D. 实验室用NH4Cl和Ca(OH)2制备NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com