
��7�֣�NH4Al��SO4��2��ʳƷ�ӹ�����Ϊ��ݵ�ʳƷ���Ӽ���
���ڱ���ʳƷ�У�NH4HSO4�ڷ����Լ���ҽҩ�����ӹ�ҵ����;�㷺����ش��������⣺
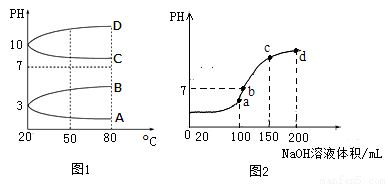
��1����ͬ�����£�������ʵ���Ũ�ȵ�NH4Al��SO4��2��c��NH4+�� ���=������>����<����NH4HSO4��c��NH4+����
��2����ͼ1��0.1mol?L��1�������Һ��pH���¶ȱ仯��ͼ��
�����з���0.1mol?L��1 NH4Al��SO4��2��pH���¶ȱ仯�������� ����д��ĸ����
������ʱ��0.1mol?L��1 NH4Al��SO4��2��2c��SO42������c��NH4+����3c��Al3+��= mol?L��1������ֵ��
��3������ʱ����100mL 0.1mol?L��1 NH4HSO4��Һ�еμ�0.1mol?L��1 NaOH��Һ���õ�����ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ2��ʾ���Է���ͼ��a��b��c��d�ĸ��㣬ˮ�ĵ���̶������� ����b�㣬��Һ�и�����Ũ���ɴ�С������˳���� ��
��7�֣���1��<��1�֣�
��2����A��1�֣� ��10��3 ����10��3 ��10��11�� ��2�֣�
��3��a ��1�֣� (Na��)>c(SO42-)>c(NH4+>c(OH��)��c(H��) ��2�֣�
��������
�����������1�� NH4Al��SO4��2�д���笠����Ӻ������ӵ�ˮ�⣬��������ƵĹ�ϵ����ˮ�ⶼ�����ģ���NH4HSO4��ֻ����笠����ӵ�ˮ�⣬��NH4HSO4��������������Ӷ�笠����ӵ�ˮ�����������ô��������Ӷ�笠�����ˮ����������ã�����ǰ�ߵ�笠�����Ũ��С�ں��ߣ�
��2���������ӡ�笠����ӵ�ˮ��ʹ��Һ�����ԣ����¶�����������ˮ��ƽ�������ƶ�����Һ��pH��С��������ǿ������a���߷��ϣ�
����A���߿�֪����ʱ��0.1mol?L��1 NH4Al��SO4��2��pH=3����c(H��)=10-3mol/L��c(OH��)=10-11mol/L�����ݵ���غ㣬��2c��SO42����+ c(OH��)=c��NH4+��+3c��Al3+��+ c(H��)������2c��SO42������c��NH4+����3c��Al3+��= c(H��)- c(OH��)= ��10-3 -10-11��mol/L��
��3��ˮ�ĵ���̶����ʱ������ˮ����ε�Ũ�����ʱ�����������Һ��������淋����ʵ�����0.01mol������������������������ȫ��Ӧʱǡ����������泥���ʱ笠����ӵ�Ũ���������Һ��ֻ����笠����ӵ�ˮ�⣬ˮ�ĵ���̶���������������Ƶ������100mL������Ϊa�㣻b��ʱ��Һ�����ԣ���c(OH��)��c(H��)����ʱ��ҺΪ�����ơ�����李�һˮ�ϰ��Ļ��Һ������100mL������������Һʱ������������������ӵ�Ũ����ȣ�����b��ʱ(Na��)>c(SO42-)������Һ������Ũ�ȵĴ�С��ϵ��(Na��)>c(SO42-)>c(NH4+>c(OH��)��c(H��)��
���㣺����Ӱ����ˮ��ƽ������أ�����Ũ�ȵıȽϣ�ͼ��ķ���


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�������ʡ�������и�����ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
ͬ��ͬѹ�£�������ܶ�֮�ȵ�����Է�������֮�ȣ���֪������ƽ����Է�������Ϊ29��ͬ��ͬѹ�£�����������ܶȱȿ����ܶ�С����
A���������� B��������̼ C���������� D��һ����̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡЭ���������ѧ�ڵڶ����¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���ڹ�ũҵ�������ճ��������뻯ѧ�йص����⣬������ʶ����ȷ����
A�������Ȼ�����ѩ����ʹ�û�ӿ������ĸ�ʴ
B�����Ͻ�Ĵ���ʹ������Ϊ�������ý�̿�Ȼ�ԭ�����������л�ȡ��
C����������Ϣ��ҵ���й㷺Ӧ�ã�������µ���Ҫ�����Ƕ�������
D�����½ṹ�մɵ����裨Si3N4�����нϸߵ�Ӳ�Ⱥ���ĥ�ԣ���������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ�����и���һ�»�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ڷ�ӦCO2(g)+H2(g)  CO(g)+H2O(g) ��H>0����������������������
CO(g)+H2O(g) ��H>0����������������������
A������������ı��˷�Ӧ�����ʣ���Ӧ�Ħ�HҲ��֮�ı�
B�������¶ȣ���Ӧ���ʼ�������Ӧ�ų�����������
C���ı䷴Ӧ��ϵ�����ƽ�ⲻ�����ƶ�����Ӧ�ų�����������
D������������Ӧ��Ϊ��ȼ�ϵ�ؽ��У���Ӧ�ų�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ���ݵ���7У������ѧ����ĩģ��������ѧ�Ծ��������棩 ���ͣ�������
ijϡ�����ϡ����Ļ����Һ200 mL��ƽ���ֳ����ݡ�������һ��������ͭ�ۣ�������ܽ�19.2 g����֪����ֻ����ԭΪNO���壩������һ�����������ۣ�������������������������ӵı仯����ͼ��ʾ��

��1�����ݸ��Բ�����NO�������ʵ��� (���ȡ�����ȡ���
��2����������ʵ���Ũ�� ,��������ʵ���Ũ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ���ݵ���7У������ѧ����ĩģ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£���20mL a mol��L-1CH3COOH��Һ����μ���0.1mol��L-1 NaOH��Һ����pH�仯������ͼ��ʾ������˵���У���ȷ����
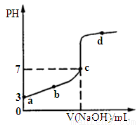
A��a=1��10-3
B��V(NaOH)=200amLʱ����Һ�У�c (Na+)= c(CH3COO-)+ c(CH3COOH)=0.1mol��L-1
C���õζ�ʵ��ʹ�ü�����ָʾ��
D��d��֮�����Һ������Ũ�ȴ�С��ϵ�������㣺c(Na+)��c(OH-)��c(CH3COO-)��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ���ݵ���7У������ѧ����ĩģ��������ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й�ʵ��װ�ý��е���Ӧʵ�飬�ܴﵽʵ��Ŀ�ĵ���
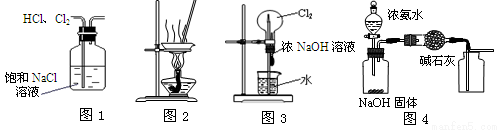
A����ͼ1��ʾװ�ó�ȥHCl�к��е�����Cl2
B����ͼ2��ʾװ������FeCl3��Һ�Ʊ���ˮFeCl3
C����ͼ3��ʾװ�ÿ�����ɡ���Ȫ��ʵ��
D����ͼ4��ʾװ����ȡ���ռ����﴿����NH3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ�����и�����ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�±�������������������ȷ���һ�Ϊ�����ϵ����
ѡ�� | ������ | ������ |
A | NH4Cl��ǿ�������� | ��NH4Cl��Һ���ɿ��Ʊ�NH4Cl���� |
B | Fe3+��ǿ������ | ��KSCN��Һ���Լ���Fe3+ |
C | SO2�л�ԭ�� | ��SO2��ʹ��ˮ��ɫ |
D | Cl2��Ư���� | ��Cl2����ʯ���鷴Ӧ�Ʊ����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��ӱ�ʡ����12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
һ���¶��£�10mL0.40mol/L H2O2��Һ�������ֽ⡣��ͬʱ�̲ⶨ����O2�������������Ϊ��״�������±���
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
������������ȷ���ǣ���Һ����仯���Բ��ƣ�
A��0~6min��ƽ����Ӧ���ʣ�v(H2O2)��3.3��10-2mol/(L?min)
B��6~10min��ƽ����Ӧ���ʣ�v(H2O2)<3.3��10-2mol/(L?min)
C����Ӧ��6minʱ��c(H2O2)=0.3mol/L
D����Ӧ��6minʱ��H2O2�ֽ���50%
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com