
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、NO3-、AlO2- | ||
| C. | K+、MnO4-、NH4+、NO3- | D. | Fe2+、K+、SO42-、NO3- |
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C与B同周期,核外有三个未成对电子;D元素的基态原子核外有8种运动状态的电子;E元素的最高正价与最低负价的代数和为4;F元素的正三价离子的3d轨道为半充满;请回答下列问题:
已知A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C与B同周期,核外有三个未成对电子;D元素的基态原子核外有8种运动状态的电子;E元素的最高正价与最低负价的代数和为4;F元素的正三价离子的3d轨道为半充满;请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓烧碱溶液中加入铝片:A1+2OH-+2H2O═[A1(OH)4]-+H2↑ | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3一═CaCO3↓+H2O | |
| C. | 食醋和小苏打溶液混合;CH3COOH+HCO3一═CH3COO-十H2O+CO2↑ | |
| D. | 敞开体系,向FeC12溶液滴加NaOH溶液:4Fe2++8OH-+O2+2H2O═4Fe (OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、AlO2-、Cl-、SO42- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | Ca2+、Fe2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、HSO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g)△H<0,设计制备磺酰氯(SO2Cl2)的装置如图,有关信息如表所示. | SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 | / | / |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示的装置,两烧杯中均为相应的水溶液,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极上析出0.24g某金属,下列说法正确的是( )
如图所示的装置,两烧杯中均为相应的水溶液,通电一段时间后,测得甲池中某电极质量增加2.16g,乙池中某电极上析出0.24g某金属,下列说法正确的是( )| A. | 某盐溶液可能是Mg(NO3)2溶液 | |
| B. | 甲池是a极上析出金属银,乙池是d极上析出某金属 | |
| C. | 甲池是b极上析出金属银,乙池是c极上析出某金属 | |
| D. | 某盐溶液可能是CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新型材料聚酯纤维、光导纤维都属于有机高分子 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| C. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| D. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
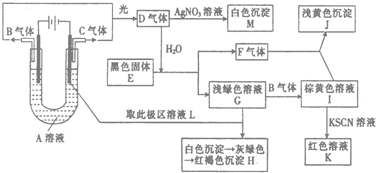
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
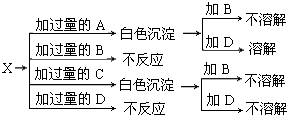
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com