
| 试管 | 未加MnSO4的试管 | 加有MnSO4的试管 |
| 褪色时间 | 30s | 2s |
| 试管 | 未滴加稀硫酸的试管 | 滴加了稀硫酸的试管 |
| 褪色时间 | 100s | 90s |
| 试管 | 滴入10滴稀硫酸的试管 | 加入1mL稀硫酸的试管 | 加入2mL稀硫酸的试管 |
| 褪色时间 | 70s | 100s | 120s |
| Mn2+ |
| Mn2+ |
| Mn2+ |
| C2O42- |


科目:高中化学 来源: 题型:
| A、CO2属于温室气体 |
| B、太阳能电池可将太阳能直接转化为电能 |
| C、太阳能属于新能源 |
| D、乙醇属不可再生能源,乙醇燃烧不会产生温室气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
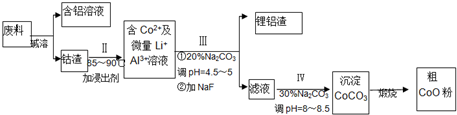

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 生理盐水,是指生理学实验或临床上常用的渗透压与动物或人体血浆的渗透压相等的氯化钠溶液.浓度:用于两栖类动物时是0.67~0.70%,用于哺乳类动物和人体时是0.85~0.9%人们平常点滴用的氯化钠注射液浓度是0.9%,可以当成生理盐水来使用.请回答下面有关点滴用的氯化钠注射液的问题.
生理盐水,是指生理学实验或临床上常用的渗透压与动物或人体血浆的渗透压相等的氯化钠溶液.浓度:用于两栖类动物时是0.67~0.70%,用于哺乳类动物和人体时是0.85~0.9%人们平常点滴用的氯化钠注射液浓度是0.9%,可以当成生理盐水来使用.请回答下面有关点滴用的氯化钠注射液的问题.查看答案和解析>>
科目:高中化学 来源: 题型:
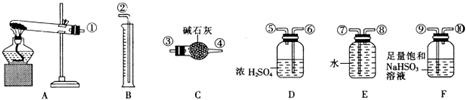
| 实验小组 | 称取硫酸铜的质量(g) | 装置c增加的质量(g) | 量筒中谁的体积折算成标准状况下气体的体积(mL) |
| 一 | 6.4 | 2.56 | 448 |
| 二 | 6.4 | 3.84 | 224 |
查看答案和解析>>
科目:高中化学 来源: 题型:
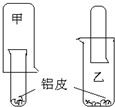 为了适应“低碳生活”,某化学兴趣小组用铝制废牙膏皮、一大一小两种试管和稀硫酸来制取并收集一试管氢气.据此完成下列要求.
为了适应“低碳生活”,某化学兴趣小组用铝制废牙膏皮、一大一小两种试管和稀硫酸来制取并收集一试管氢气.据此完成下列要求.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、应准确称取氢氧化钠固体19.2g |
| B、为了减少损失,将氢氧化钠固体直接倒入容量瓶中,加水溶解 |
| C、定容时仰视读数,所配制的溶液浓度会偏低 |
| D、摇匀后溶液液面低于刻度线,应补充适量蒸馏水至刻度线 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com