
| A. | 纯净水 | B. | 0.lmol/LHCl | C. | 1.0mol/LCH3COOH | D. | 0.5mol/LH2SO4 |
分析 溶液导电能力与离子浓度成正比、与所带电荷成正比,加入0.1molKOH后,溶液导电能力无变化,说明溶液中离子浓度变化不大,据此分析解答.
解答 解:A.水是弱电解质、KOH是强电解质,水中加入KOH后,KOH电离出阴阳离子而导致溶液中离子浓度变化较大,则溶液导电能力变化较大,故A不选;
B.HCl、KOH都是强电解质,加入0.1molKOH后,二者反应生成强电解质KCl,但KOH过量,所以溶液中离子浓度增大,则溶液导电能力增强,故B不选;
C.醋酸是弱电解质、KOH是弱电解质,加入0.1molKOH后,溶液中溶质由弱电解质醋酸变为强电解质醋酸钾,溶液中离子浓度变化较大,则溶液导电能力变化较大,故C不选;
D.硫酸和KOH都是强电解质,二者混合后恰好完全反应生成强电解质硫酸钾,溶液中离子浓度无变化,则溶液导电能力无变化,故D选;
故选D.
点评 本题考查电解质溶液导电性,为高频考点,明确影响溶液导电性强弱因素是解本题关键,注意:电解质溶液导电性强弱与离子浓度有关,与电解质强弱无关,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
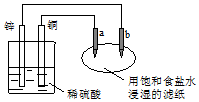
| A. | 往滤纸上滴加酚酞试液,a极附近颜色变红 | |
| B. | 锌电极上的反应:Zn-2e→Zn2+ | |
| C. | 稀硫酸中硫酸根离子的物质的量不变 | |
| D. | a是阳极,发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D、E、F和G都是有机化合物,它们的关系如图所示:
A、B、C、D、E、F和G都是有机化合物,它们的关系如图所示: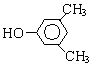 或
或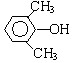 或
或 (写出一种即可).
(写出一种即可).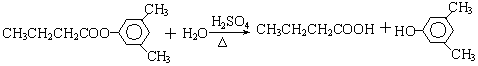 或
或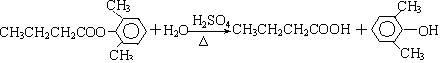
 .①反应的反应类型取代反应
.①反应的反应类型取代反应 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学研究会造成严重的环境污染,危害人们的生活 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用大量木材作燃料可以缓解当前能源不足问题 | |
| D. | 对于常见的大多数金属,其金属活动性越强,冶炼就越困难 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO和H2 | B. | C6H12O6 | C. | CH2O2 | D. | C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com