
����Ŀ��������л�ѧ����ʽ��ѡ����ȷ�𰸣�������������Ӧ�����ڡ�
a.2KClO3![]() 2KCl+3O2��
2KCl+3O2��
b.2Fe+3Cl2![]() 2FeCl3
2FeCl3
c.NH4HCO3![]() NH3��+H2O+CO2��
NH3��+H2O+CO2��
d.CaO+CO2=CaCO3
e.Cl2+H2O=HCl+HClO
(1)���ǷֽⷴӦ����������ԭ��Ӧ������_________��
(2)�ǷֽⷴӦ������������ԭ��Ӧ������_________��
(3)���ǻ��Ϸ�Ӧ����������ԭ��Ӧ������_________��
(4)�ǻ��Ϸ�Ӧ������������ԭ��Ӧ������_________��
(5)���������ֻ�����Ӧ���͵�������ԭ��Ӧ������_________��
���𰸡�a c b d e
��������
���ݷ�Ӧ����ʽ��Ԫ�ػ��ϼ��Ƿ����仯�ж��Ƿ�����������ԭ��Ӧ�����ݷ�Ӧ�����������༰�����жϻ�ѧ��Ӧ�Ļ������͡�
(1) ��Ӧ2KClO3![]() 2KCl+3O2���У���Ӧ��ֻ��һ�֣������������֣�������ڷֽⷴӦ�������ڷ�Ӧ������Cl��OԪ�صĻ��ϼ۷����˱仯����˸÷�Ӧͬʱ����������ԭ��Ӧ���ʺ���ѡ����a��
2KCl+3O2���У���Ӧ��ֻ��һ�֣������������֣�������ڷֽⷴӦ�������ڷ�Ӧ������Cl��OԪ�صĻ��ϼ۷����˱仯����˸÷�Ӧͬʱ����������ԭ��Ӧ���ʺ���ѡ����a��
(2)��ӦNH4HCO3![]() NH3��+H2O+CO2���У���Ӧ��ֻ��һ�֣������������֣�������ڷֽⷴӦ�������ڷ�Ӧ����������Ԫ�صĻ��ϼ۶�û�з����仯����˸÷�Ӧ������������ԭ��Ӧ���ʺ���ѡ����c��
NH3��+H2O+CO2���У���Ӧ��ֻ��һ�֣������������֣�������ڷֽⷴӦ�������ڷ�Ӧ����������Ԫ�صĻ��ϼ۶�û�з����仯����˸÷�Ӧ������������ԭ��Ӧ���ʺ���ѡ����c��
(3)��Ӧ2Fe+3Cl2![]() 2FeCl3�з�Ӧ�������֣�������ֻ��һ�֣�������ڻ��Ϸ�Ӧ�������ڷ�Ӧ������Cl��FeԪ�صĻ��ϼ۷����˱仯����˸÷�Ӧͬʱ����������ԭ��Ӧ���ʺ���ѡ����b��
2FeCl3�з�Ӧ�������֣�������ֻ��һ�֣�������ڻ��Ϸ�Ӧ�������ڷ�Ӧ������Cl��FeԪ�صĻ��ϼ۷����˱仯����˸÷�Ӧͬʱ����������ԭ��Ӧ���ʺ���ѡ����b��
(4)��ӦCaO+CO2=CaCO3�У���Ӧ�������֣�������ֻ��һ�֣�������ڻ��Ϸ�Ӧ�������ڷ�Ӧ����������Ԫ�صĻ��ϼ۶�û�з����仯����˸÷�Ӧ������������ԭ��Ӧ���ʺ���ѡ����d��
(5)Cl2+H2O=HCl+HClO�������κ�һ�ֻ�����Ӧ���͵��ص㣬�������ڷ�Ӧ������ClԪ�صĻ��ϼ۷����˱仯�����Է�Ӧ����������ԭ��Ӧ���ʺ���ѡ����e��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������±�25��ʱijЩ����ĵ���ƽ�ⳣ�����ж�����˵����ȷ����
CH3COOH | HC1O | H2CO3 |
Ka=1.8��l0-5 | Ka=3.0��l0-8 | Ka1=4.4��l0-7 Ka2=4.7��l0-11 |
A. ��NaClO��Һ��ͨ������CO2�����ӷ���ʽΪ��2C1O-+CO2+H2O==2HC1O+CO32-
B. ��ͬŨ�ȵ�CH3COOH��NaClO����Һ�У�ˮ�ĵ���̶�ǰ�ߴ�
C. ��0. lmol L-l��CH3COOH��Һ�еμ�NaOH��Һ��pH = 5����ʱ��Һ�� c(CH3COOH)��c(CH3COO-) =5��9
D. �����£�0 lmol L-1 �� NaHC2O4 ��Һ pH =4�� c(HC2O4-) >c(H+)>c(H2C2O4)>c(C2O42-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���Ӧ��N2(g��+3H2(g��![]() 2NH3(g����H= - 92.4kJmol-1���ڷ�Ӧ�����У�����Ӧ���ʵı仯��ͼ������˵������ȷ����( )
2NH3(g����H= - 92.4kJmol-1���ڷ�Ӧ�����У�����Ӧ���ʵı仯��ͼ������˵������ȷ����( )
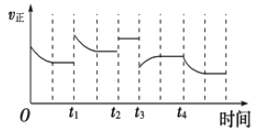
A. t1ʱ������ѹǿ
B. t2ʱʹ���˴���
C. t3ʱ�������¶�
D. t4ʱ����ϵ�з�������ְ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֤�����淴ӦN2+3H2![]() 2NH3�Ѵﵽƽ��״̬����
2NH3�Ѵﵽƽ��״̬����
��һ��N��N�����ѵ�ͬʱ����3��H��H������
��һ��N��N�����ѵ�ͬʱ����6��N��H������
��������������ʱ���������ƽ����Է����������ٸı�
�ܺ��º���ʱ����ϵѹǿ���ٸı�
��NH3��N2��H2��������������ٸı�
���º���ʱ����������ܶȱ��ֲ���
������Ӧ����v��H2��=0.6molL��1min��1���淴Ӧ����v��NH3��=0.4molL��1min��1
A. ȫ�� B. �ڢۢܢ� C. �ڢۢܢݢ� D. �ۢݢޢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯��Ҫ���뻹ԭ������ʵ�ֵ��ǣ��� ��
A.HCl![]() Cl2B.Fe
Cl2B.Fe![]() Fe3��C.KClO3
Fe3��C.KClO3![]() O2D.KMnO4��Mn2+
O2D.KMnO4��Mn2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪԪ�����������ڵĺ����ֲ���������б�������ȷ���ǣ� ��
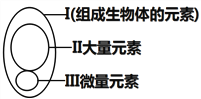
A. ���ڷ�������ж����ҵ�����������������������ͳһ��
B. �������٣�ȴ���������������������ȱ�ٵ�
C. ��͢�Ϊ������ı���Ԫ�أ�һ��ȱ���Ϳ��ܻᵼ����Ӧ�IJ�֢
D. P��S��K��Ca��Fe���ڴ���Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ����Ҫ�Ļ���ԭ�ϡ������й�˵���������( )
A. ����ϩ�ɷ����Ӿ۷�Ӧ B. ����ϩ��һ�������¿���Һ�巢��ȡ����Ӧ
C. ����ϩ����������̼ԭ��һ����ƽ�� D. ����ϩ�ı����ϵ�һ�ȴ�����3 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cl2��NaOH��Һ��Ӧ������NaCl��NaClO��NaClO3(Cl-��ClO-)�ı�ֵ�뷴Ӧ���¶��йأ���24gNaOH��ɵ�250mL��Һ����Cl2ǡ����ȫ��Ӧ������Cl2��ˮ�ķ�Ӧ�������ˮ�⼰��Һ����仯����
��1��NaOH��Һ�����ʵ���Ũ��_____mol��L��1��
��2��ij�¶��£���Ӧ����Һ��c(Cl-)=6c(ClO-)������Һ��c(ClO-) =_____mol��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ú�ת��NO2��SO2��CO��NO����Ⱦ�������ǻ����������Ҫ���⡣
��1����CH4����ԭ�������������������������Ⱦ����֪��
��CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ��H=��574.0kJ/mol
��CH4(g)+4NO(g)=2N2(g)+CO2 (g)+2H2O(g) ��H=��1160.0 kJ/mol
��H2O(g)=H2O(1) ��H=��44.0 kJ/mol
CH4(g)��NO2(g)��Ӧ����N2(g)��CO2(g)��H2O(���Ȼ�ѧ����ʽ��__________________��
��2����֪2NO(g)+O2(g)![]() 2 NO2(g)�ķ�Ӧ���̷�������
2 NO2(g)�ķ�Ӧ���̷�������
��2NO(g)![]() N2O2(g)(��) v1��=k1����c2(NO)��v1��=k1����c(N2O2)
N2O2(g)(��) v1��=k1����c2(NO)��v1��=k1����c(N2O2)
��N2O2(g)+O2(g)![]() 2 NO2(g) (��) v2��=k2����c (N2O2)��c(O2)�� v2��=k2����c 2(NO2)
2 NO2(g) (��) v2��=k2����c (N2O2)��c(O2)�� v2��=k2����c 2(NO2)
һ���¶��£���Ӧ2NO(g)+O2(g)![]() 2 NO2(g)�ﵽƽ��״̬���÷�Ӧ��ƽ�ⳣ���ı���ʽK=______________________(��k1����k1����k2����k2����ʾ)����Ӧ�ٵĻ��E1�뷴Ӧ�ڵĻ��E2�Ĵ�С��ϵΪE1___________E2���������������=����
2 NO2(g)�ﵽƽ��״̬���÷�Ӧ��ƽ�ⳣ���ı���ʽK=______________________(��k1����k1����k2����k2����ʾ)����Ӧ�ٵĻ��E1�뷴Ӧ�ڵĻ��E2�Ĵ�С��ϵΪE1___________E2���������������=����
��3���û���̿��ԭ����������������йط�ӦΪ��C(s)+2NO(g)![]() N2(g)+CO2(g)��
N2(g)+CO2(g)��
������ܱ������м���һ�����Ļ���̿��NO������(T��)ʱ�������ʵ�Ũ����ʱ��ı仯���±���

��T��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ___________(������λ��Ч����)
����31minʱ����ֻ�ı�ijһ����ʹƽ�ⷢ���ƶ���40min��50minʱ�����ʵ�Ũ�����ϱ���ʾ����ı��������______________________��
����51minʱ�������¶Ⱥ�������������ٳ���NO��N2��ʹ���ߵ�Ũ�Ⱦ�������ԭ������������ѧƽ��___________(���������ƶ������������ƶ����������ƶ���)��
��4����ӦN2O4(g)![]() 2NO2(g) ��H>0����һ��������N2O4��NO2��������������Եķ�ѹ(��ѹ=��ѹ�����ʵ�������)�����¹�ϵ��v(N2O2)=k1��p(N2O4)��v(NO2)=k2��p2(NO2)����k1��k2�����¶��йصij�������Ӧ��������N2O4��NO2�ķ�ѹ��ϵ��ͼ��ʾ��
2NO2(g) ��H>0����һ��������N2O4��NO2��������������Եķ�ѹ(��ѹ=��ѹ�����ʵ�������)�����¹�ϵ��v(N2O2)=k1��p(N2O4)��v(NO2)=k2��p2(NO2)����k1��k2�����¶��йصij�������Ӧ��������N2O4��NO2�ķ�ѹ��ϵ��ͼ��ʾ��

��T��ʱ��ͼ��M��N���ܱ�ʾ�÷�Ӧ�ﵽƽ��״̬��������______________________���ı��¶ȣ�v(NO2)����M���ΪA��B��C��v(N2O4)����N���ΪD��E
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com