
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为_____________________。
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。

(3)胆矾CuSO4·5H2 O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:
O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:
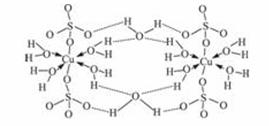
下列说法正确的是_________________(填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_____________________。
(5)Cu2O的熔点比Cu2S的______________(填“高”或“低”),请解释原因____________________________。
(1)1s22s22p63s23p63d9或[Ar]3d9
(2)4
(3)BD
(4)F的电负性比N大,N—F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子
(5)高
Cu2O与Cu2S相比,阳离子相同、阴离子所带电荷也相同,但O2 -的半径比S2-小,所以Cu2O的晶格能更大,熔点更高
-的半径比S2-小,所以Cu2O的晶格能更大,熔点更高
【解析】(1)Cu原子成为Cu2+,失去最外层电子。
(2)确定微粒数目,注意共用情况。
(3)由结构示意图知,胆矾晶体中不存在离子键,受热时分步失H2O。
(5)离子晶体熔、沸点高低比较中,要通过离子半径的大小比较键的强弱,从而确定熔、沸点高低。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第________周期第________族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为________________________。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是________________________________________________________________________
________________________________________________________________________。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
 是常规核裂变产物之一,可以通过测定大气或水中
是常规核裂变产物之一,可以通过测定大气或水中 的含量变化来检测核电站是否发生放射性物质泄漏。下列有关
的含量变化来检测核电站是否发生放射性物质泄漏。下列有关 的叙述中错误的是
的叙述中错误的是
A.  的化学性质与
的化学性质与 相同 B.
相同 B.  的原子序数为53
的原子序数为53
C.  的原子核外电子数为78 D.
的原子核外电子数为78 D.  的原子核内中子数多于质子数
的原子核内中子数多于质子数
查看答案和解析>>
科目:高中化学 来源: 题型:
碳族元素包括:C、Si、 Ge、 Sn、Pb。
(1)碳纳米管有单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过 杂化与周围碳原子成键,多层碳纳米管的层与层之间靠 结合在一起。
(2)CH4中共用电子对偏向C,SiH4中共用电子对偏向H,则C、Si、H的电负性由大到小的顺序为 。
(3)用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.金属与盐溶液的反应都是置换反应
B.阴离子都只有还原性
C.与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物
D.分子晶体中都存在范德瓦耳斯力,可能不存在共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的一种同位素X的原子质量数为A,含N个中子,它与1H原子组成HmX分子。在a g HmX中所含质子的物质的量是
A.  mol B.
mol B.  mol
mol
C.  mol D.
mol D. 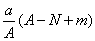 mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A. 分子晶体中的每个分子内一定含有共价键
B. 原子晶体中的相邻原子间只存在非极性共价键
C. 离子晶体中可能含有共价键
D.金属晶体的熔点和沸点都很高
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.所有的放热反应都能在常温常压下自发进行
B.Ba(OH)2 8H2O与NH4Cl反应属放热反应
8H2O与NH4Cl反应属放热反应
C.天然气燃烧时,其化学能全部转化为热能
D.反应热只与反应体系的始态和终态有关,而与反应的途径无关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com