
| A、酸性:H3PO4>HNO3>HClO4 |
| B、稳定性:HF>H2O>NH3 |
| C、微粒半径:F->Na+>Mg2+ |
| D、碱性:KOH>NaOH>Mg(OH)2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
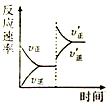 一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g)?pC(g)+qD(s),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )
一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g)?pC(g)+qD(s),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是( )| A、正反应是放热反应 |
| B、逆反应是放热反应 |
| C、m+n<p+q |
| D、m+n>p+q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 项 | 表述Ⅰ | 表述Ⅱ |
| A | SiO2是酸性氧化物 | SiO2不能与酸反应 |
| B | 乙烯能使溴的四氯化碳溶液和酸性高锰酸钾溶液退色 | 二者退色原理相同 |
| C | BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀 | 说明Ksp(BaSO4)>Ksp(BaCO3) |
| D | 向FeCl2溶液中加入过量H2O2,溶液颜色由浅绿色变成黄色 | 氧化性:H2O2>Fe3+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升温可以加快合成SO3的速率同时提高SO2的转化率 |
| B、寻找常温下的合适催化剂是未来研究的方向 |
| C、由于△H<0,△S<0,故该反应一定能自发进行 |
| D、当v(O2)生成?2v(SO3)消耗时,说明反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、500mL2mol?L-1稀硫酸 |
| B、150mL5mol?L-1稍酸 |
| C、50mL3mol?L-1盐酸 |
| D、500mL2mol?L-1稀硫酸和少量硫酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、方程式中化学计量数表示分子数 |
| B、△H2>0 |
| C、△H2=-△H1 |
| D、利用△H1,△H2可求出水的气化热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、干冰升华要吸收大量的热,这就是化学反应中的吸热反应 |
| B、凡是在加热或点燃条件下进行的反应都是吸热反应 |
| C、人们用氢氧焰焊接或切割金属,主要是利用了氢气和氧气化合时所放出的能量 |
| D、明矾有净水作用,所以用明矾处理硬水,可以使硬水软化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2 S Na2SO4 |
| B、Si SiO2 Na2SiO3 |
| C、CO2 Na2CO3 C |
| D、Al Al2O3 Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
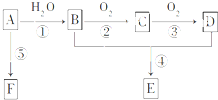 已知A是一种相对分子质量为42的气态烃,它可转化为其他常见有机物,转化关系如图所示.
已知A是一种相对分子质量为42的气态烃,它可转化为其他常见有机物,转化关系如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com