
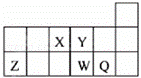
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )
|
| A. | 元素X与元素Z的最高正化合价之和的数值等于8 |
|
| B. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ |
|
| C. | 离子Y2﹣和Z3+的核外电子数和电子层数都不相同 |
|
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
考点:
位置结构性质的相互关系应用.
专题:
元素周期律与元素周期表专题.
分析:
根据元素所在周期表中的位置判断元素的种类,结合元素周期律的递变规律解答该题
解答:
解:由元素所在周期表中的位置可知,X为N元素,Y为O元素,Z为Al元素,W为S元素,Q为Cl元素.
A、X为N元素,最高正价为+5价,Z为Al元素,最高正价为+3价,则元素X与元素Z的最高正化合价之和的数值等于8,故A正确;
B、原子核外电子层数越多,半径越大,同一周期元素原子半径从左到右逐渐减小,则有:rZ>rW>rQ>rX>rY,故B错误;
C、离子Y2﹣和Z3+的核外电子数都为10,离子核外有2个电子层,电子层数相同,故C错误;
D、同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物的水化物的酸性逐渐增强,故D错误.
故选A.
点评:
本题考查位置结构性质的相互关系及应用,题目难度中等,注意掌握元素周期表的结构和元素周期律的递变规律.


科目:高中化学 来源: 题型:
已知反应A(g)+3B(g)⇌2C(g)+2D(g),下列反应速率最大的是( )
A.v(D)=0.4 mol•L﹣1•s﹣1 B.v (C)=0.5 mol•L﹣1•s﹣1
C.v (B)=0.6 mol•L﹣1•s﹣1 D.v (A)=0.15 mol•L﹣1•s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
Fe(OH)3胶体虽然是由FeCl3溶液制得,但两者是截然不同的两种物质.FeCl3溶液、Fe(OH)3胶体共同具备的性质是( )
A. 都呈透明的红褐色
B. 分散质颗粒直径相同
C. 都比较稳定,密封保存一段时间都不会产生沉淀
D. 当有光线透过时,都能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
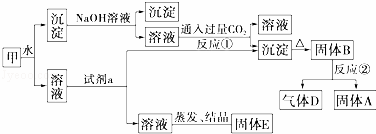
某混合物甲中含有明矾[KAl(SO4)2]、Al2O3和Fe2O3.在一定条件下由甲可实现如图所示的物质之间的转化:
请回答下列问题:
(1)写出A、B、D的化学式:A 、B 、D .
(2)试剂a最好选用 (选填A、B、C、D).
A.NaOH溶液 B.稀盐酸 C.二氧化碳 D.氨水
(3)写出反应①的离子方程式: .
(4)固体E可以作为复合性的化学肥料,E中所含物质的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)⇌SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如右所示.由图可得出的正确结论是( )
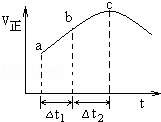
|
| A. | 反应在c点达到平衡状态 |
|
| B. | 反应物浓度:a点小于b点 |
|
| C. | 反应物的总能量低于生成物的总能量 |
|
| D. | △t1=△t2时,SO2的转化率:a~b段小于b~c段 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学进行试验探究时,欲配制1.0mol•L﹣1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2•8H2O试剂(化学式量:315).在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在大量未溶物.为探究原因,该同学查得Ba(OH)2•8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6.
(1)烧杯中未溶物仅为BaCO3,理由是
(2)假设试剂由大量Ba(OH)2•8H2O和少量BaCO3组成,设计试验方案,进行成分检验,在答题卡上写出实验步骤、预期现象和结论.(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. |
|
| 步骤2:取适量滤液于试管中,滴加稀硫酸. |
|
| 步骤3:取适量步骤1中的沉淀于是试管中, |
|
| 步骤4: |
|
(3)将试剂初步提纯后,准确测定其中Ba(OH)2•8H2O的含量.实验如下:
①配制250ml 约0.1mol•L﹣1Ba(OH)2•8H2O溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水, ,将溶液转入 ,洗涤,定容,摇匀.
②滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将
(填“0.020”、“0.05”、“0.1980”或“1.5”)mol•L﹣1盐酸装入50ml酸式滴定管,滴定至终点,记录数据.重复滴定2次.平均消耗盐酸Vml.
(4)室温下, (填“能”或“不能”) 配制1.0mol•L﹣1Ba(OH)2溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
根据图示判断下列叙述符合事实的是
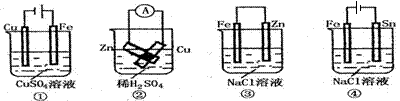 |
A.按图①连接并放置一段时间后,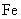 片表面会“镀”上一层铜
片表面会“镀”上一层铜
B.按图②连接好导线后(Zn片与Cu片相接触),灵敏电流表会发生非常明显的偏转
C.按图③连接并放置片刻,在Fe片附近加一滴KSCN溶液,溶液变为深红色
D.按图④连接并放置一段时间后,在Sn片上有无色气泡聚集
查看答案和解析>>
科目:高中化学 来源: 题型:
对于0.1mol•L-1Na2SO3 溶液,正确的是( )
A. 升高温度,溶液的pH降低
B. 加入少量NaOH固体,c(SO32- )与c(Na+ )均增大
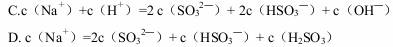
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com