
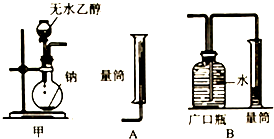
分析 (1)a g乙醇完全燃烧生成b mol二氧化碳和c mol水,可知n(C)=bmol,n(H)=2cmol,进而计算m(C)、m(H),可知ag乙醇含有氧元素的质量;
(2)氢气难溶于水,可以采用排水法测量氢气的体积;
(3)金属钠易被氧化变质,取用金属钠需要除去表面的杂质,取用固体药品需要用镊子;剩余金属钠需要放回原试剂瓶;
(4)由于是采用的排水法测定的氢气的体积,故不需要对氢气进行干燥;
(5)乙醇分子中含有3种化学环境不同的H,据此解答即可;
(6)乙醇分子中只有羟基上的H原子可以生成氢气,据此解答即可.
解答 解:(1)a g乙醇完全燃烧生成b mol二氧化碳和c mol水,可知n(C)=bmol,n(H)=2cmol,则乙醇中碳、氢元素的物质的量比:n(C):n(H)=b:2c,则m(C)=12bg,m(H)=2cg,所以m(O)=ag-12bg-2cg=(a-12b-2c)g,故答案为:b;2c;a-12b-2c;
(2)氢气难溶于水,利用排水法可以测量氢气的体积,故选用装置B可以准确测量,故答案为:B;
(3)A、金属钠易被氧化变质,取用金属钠需要除去表面的杂质,故A正确;
B、取用固体药品需要用镊子,不能用手拿,故B错误;
C、由于金属钠遇水等容易生成氢气,为易燃易爆炸物质,故剩余金属钠需要放回原试剂瓶,故C错误,
故选A;
(4)由于是采用的排水法测定的氢气的体积,故不需要对氢气进行干燥,故答案为:否;
(5)乙醇分子中含有3种化学环境不同的H原子,分别为甲基上3个,亚甲基上2个和羟基中1个,故不可能有4个H转化为氢气,故选D;
(6)乙醇中只有羟基上的H能生成氢气,4.6g乙醇的物质的量=$\frac{4.6g}{46g/mol}$=0.1mol,故能生成氢气的H原子物质的量=0.1mol,即生成氢气的体积=0.1mol×$\frac{1}{2}$×22.4L/mol=1.12L=1120mL,故答案为:1120.
点评 本题主要考查有关有机化合物分子式的确定,为高频考点,侧重学生的分析、计算能力的考查,难度较小,注意把握计算的角度和方法.


科目:高中化学 来源: 题型:选择题
| A. | 加水稀释,氨水溶液中导电粒子的数目减少 | |
| B. | 通入HCl气体,氨水溶液中NH3•H2O的电离平衡向右移动,溶液的pH增大 | |
| C. | 由0.1mol/L一元碱BOH溶液的 pH=10,可推知BOH溶液中存在BOH═B++OH- | |
| D. | 由0.1mol/L一元酸HA溶液的 pH=3,可推知NaA溶液中存在A-+H2O═HA+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
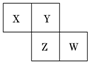 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 最高价氧化物对应水化物的酸性W比Z弱 | |
| B. | 只由这四种元素不能组成有机化合物 | |
| C. | Z的单质与氢气反应较Y剧烈 | |
| D. | X、Y形成的化合物都易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,11.2LCI2含有的分子数为NA | |
| B. | 32gO2中所含有的氧原子数为NA | |
| C. | 2.4g镁变成镁离子,转移的电子数为0.2NA | |
| D. | 1L0.3mol/LK2SO4溶液中含有的K+数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 非金属性:Z<T<X | B. | R与Q的电子数相差26 | ||
| C. | 气态氢化物稳定性:R<T<Q | D. | 最高价氧化物的水化物的酸性:T>Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素和淀粉遇碘水均呈蓝色 | |
| B. | 油脂可用来制造肥皂 | |
| C. | 石油分馏得到的汽油是纯净物 | |
| D. | 煤的气化属于物理变化,煤的干馏属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2分子比例模型: | B. | NH4I的电子式: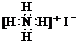 | ||
| C. | 乙醇的结构简式:C2H5OH | D. | K+最外层电子排布式:4S24P6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XYZ | B. | X2YZ | C. | X2Y2Z4 | D. | X2YZ3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com